簡介
除燃燒反應以外的其他化學反應的反應熱測量技術。從歷史和目前發展的情況來看,反應量熱學測定的是以下反應的反應熱:不飽和烴的加氫反應、鹵化反應和不飽和烴與鹵化氫的加合作用;水解反應;溶解反應;聚合反應;配位化合物的生成反應。
反應熱的測定,除了可為化工生產提供必要的設計數據外,還可用來計算反應中的某一反應物或產物的生成熱。從熱化學的觀點來看,後者也是很重要的,例如G.B.吉斯夏科夫斯基等曾測出下列加氫反應:
H2(g)+C2H4(g)─→C2H6(g)
的標準反應熱為: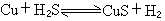 千焦/摩爾。已知以下關係式:
千焦/摩爾。已知以下關係式: 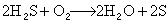
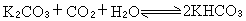 是化合物的標準生成熱;g表示該物質為氣態。如果
是化合物的標準生成熱;g表示該物質為氣態。如果 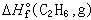 或
或 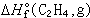 為已知,則可算出
為已知,則可算出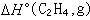 或
或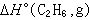 。 利用反應量熱法直接測量反應熱,或從反應熱計算其中某一反應物或產物的生成熱,所需的量熱計精度(指精確度和準確度)可以低一些。與之相比,用燃燒量熱法(見燃燒量熱學)測定同樣精度的化合物生成熱,或由其所測得的有關化合物生成熱來計算某一反應熱時,量熱計的精度要求高一個數量級以上。但是用反應量熱法直接測量反應熱時,不僅要把反應熱測至所需之精度,同時還要求反應量的測量精度。所以,只有那些反應比較徹底的和副反應很弱或可以通過分析加以校正的反應,才能用反應量熱法來考察。對於大多數反應來說,不一定能找到合適的催化劑,使反應達到上述的要求;而在燃燒反應中,一般含碳、氫、氧、氮元素的有機化合物的反應徹底而副反應甚少,反應量容易測量。另外,要從反應熱求得其中某一化合物的生成熱,還須知道其餘的反應物或產物的生成熱,這些生成熱不一定能從反應量熱法得到,而需要賃借其他量熱法。
。 利用反應量熱法直接測量反應熱,或從反應熱計算其中某一反應物或產物的生成熱,所需的量熱計精度(指精確度和準確度)可以低一些。與之相比,用燃燒量熱法(見燃燒量熱學)測定同樣精度的化合物生成熱,或由其所測得的有關化合物生成熱來計算某一反應熱時,量熱計的精度要求高一個數量級以上。但是用反應量熱法直接測量反應熱時,不僅要把反應熱測至所需之精度,同時還要求反應量的測量精度。所以,只有那些反應比較徹底的和副反應很弱或可以通過分析加以校正的反應,才能用反應量熱法來考察。對於大多數反應來說,不一定能找到合適的催化劑,使反應達到上述的要求;而在燃燒反應中,一般含碳、氫、氧、氮元素的有機化合物的反應徹底而副反應甚少,反應量容易測量。另外,要從反應熱求得其中某一化合物的生成熱,還須知道其餘的反應物或產物的生成熱,這些生成熱不一定能從反應量熱法得到,而需要賃借其他量熱法。 用途
在某些情況下,反應量熱法卻是很有用的。例如,許多金屬有機化合物往往難以充分燃燒,從而得不到確定的燃燒終態,使燃燒量熱法難以得到滿意的生成熱數據,而反應量熱法卻有可能避免這一困難。例如,可以利用一些水解反應:Zn(CH3)2+2H2O─→Zn(OH)2+2CH4(g)
Cd(CH3)2+2H2O─→Cd(OH)2+2CH4(g)
來求得這些金屬化合物的生成熱。當然,仍需要一個或幾個金屬化合物的生成熱作為基準數據,例如上列反應中的氫氧化鋅和氫氧化鎘的生成熱。反應量熱法可以用於一些生化反應。酶與其底物的反應所得產物單一,基本上沒有副反應。利用反應量熱法測量其反應熱,或用其熱效應追蹤反應歷程,都是可行的。反應量熱法也可用於研究蛋白質的變性過程。這些熱效應往往與生物分子所處的環境,例如pH、離子強度、溫度等有關。對於這類過程,反應量熱法可能是唯一可行的熱效應測量或追蹤手段;而用其他量熱方法,例如燃燒量熱法時,欲求得其反應熱,必須對乾燥的原生和變性後的生物分子進行燃燒熱測定,但乾燥後的生物分子已經和溶液中的形態不同了。
溶解反應量熱法
此法對無機熱化學研究特別重要。例如,利用溶解反應可測定UF4(s)的生成熱ΔHf(UF4,s):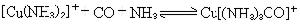
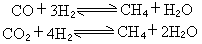
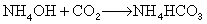
反應量熱法還可以用於配位化合物的生成熱的測定,從而可以對配位鍵進行研究(見滴定量熱法)。
反應量熱計
目前大約已有 200種以上各種類型的量熱計,選擇哪種類型的量熱計,主要考慮下列幾個因素:反應速率;待測熱效應的大小;實驗溫度;所要求達到的精度;反應中出現的相(氣、液、固)的數目;反應物和產物是否有腐蝕性。如果出現氣相,要考慮在實驗中施加的壓力。
目前設計的量熱計,大都只能測量較快反應的反應速率,即反應能在半小時至一小時內完成的。對於緩慢反應,現有一種泰安-卡爾維特型熱導式量熱計,可以測量幾小時、幾天甚至更長時間的微小熱功率,所以可以用它來追蹤緩慢反應的進展,特別可以用來追蹤一些生物反應,例如細菌培養、種子發芽等過程。
一般的反應量熱計,都只能在室溫或稍高的溫度下進行測量。高溫反應量熱計的設計比較困難,目前還難以達到常溫量熱計的水平。泰安-卡爾維特熱導式量熱計溫度可使用到1000℃,但其精度不如常溫時。高溫反應量熱計在研究冶金熱化學方面占有重要地位。
目前,常溫反應量熱計已有從1%至0.01%~0.02%的各種不同精度等級的設計方案,但是反應熱的測定精度不僅取決於量熱的精度,還決定於在量熱計中進行的反應的反應量測定精度。如果反應量只能分析到1%,則採用精度為0.01%的量熱計設計方案就沒有意義了。
簡單的窄頸杜瓦瓶量熱計,一般容量為1升左右,就可用來研究水溶液中的反應。瓶口塞上塑膠瓶塞,瓶塞上打適當數目的孔,以便放入轉速恆定的攪拌器、溫度計、電阻加熱器和樣品安瓿的支架。瓶塞最好用一具有同樣孔數的,並下垂至頸底的金屬帽蓋住。這樣,量熱計雖然不能整個浸入恆溫液體內,但通過金屬帽的良好導熱,使未浸入部分也大致處於恆溫環境之中。這樣的量熱計應能達到 0.5%左右的精度。其優點是簡單、便宜、易於加工和操作方便;主要缺點是由於量熱計記憶體在塑膠、玻璃等熱絕緣材料,需要較長的時間才能達到熱平衡。
溫度計的合理選擇,在量熱計的設計中至關重要。水銀溫度計(例如貝克曼溫度計)有一些缺點,例如,它的毛細管一般暴露在恆溫槽外;水銀面的運動不規則;在精密的測量中還需考慮壓力效應,所以,在量熱技術上,目前基本上用電阻溫度計和熱電偶溫度計代替水銀溫度計。電阻溫度計(如鉑電阻溫度計)具有準確和良好的重現性,並適用於高溫量熱,在中國已作為商品出售,一般在室溫下電阻值為25歐,每一攝氏度改變0.1歐左右。因此,要測量0.001℃的溫差時,電阻的變化需測至0.0001歐。這需要精度很高的電橋或電位差計。
熱敏電阻是由一些金屬氧化物燒結而成的半導體材料,它的顯著特性是在常溫下具有高阻值和很高的電阻溫度係數。例如,一支在室溫下為2000歐的熱敏電阻溫度計,從20℃升至21℃時,電阻下降約100歐。因此,要測準至0.001℃的溫差,只需測準至0.1歐的電阻變化。這樣,電橋的接觸電阻和導線電阻的改變,就可忽略不計,所以,一般電橋配合以靈敏度較高的檢流計,就能將溫差測至0.001℃。
用於氣相反應時,可對上述量熱計加以改裝。要點是將反應氣體保持恆溫後並以恆定流速引入到一浸於量熱液體中的反應室,使反應在反應室內進行。反應產物(氣體)先作廢氣排放。當量熱計的溫度與時間曲線成線性時,表示氣體反應物和氣體產物在催化劑上達到吸附平衡。此時,在一定時間間隔內對產物(氣體)或反應物(氣體)進行定量分析,並同時測量同一時間間隔內的溫度改變。隨後,可用電能對量熱計進行能量當量標定。測量的成敗,在很大程度上取決於反應的完全性和有無副作用,換言之,決定於催化劑的選擇。