涵義
 別構調節
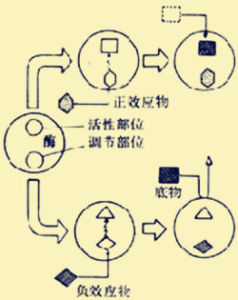
別構調節別構調節(allostericregulation)又稱別位調節或變構調節。受別構調節的酶稱為別位酶(aIlostericenzyme)。某些小分子物質(如代謝物)可與酶蛋白的特殊部位結合,引起其構象(conformation)變化,由此改變其酶活性。這類物質稱為效應物(effector)。別構調節不引起酶的構型(configuration)變化,不涉及共價鍵變化。
別構酶多是關鍵酶(如限速酶)。此類酶所催化的反應常是不可逆反應。這一代謝過程如有逆向過程,則由另一種酶催化。例如,磷酸化酶可催化糖原分解,此反應不可逆,其逆向代謝過程由糖原合成酶催化,使糖原得以合成。糖原磷酸化酶與糖原合成酶都是別位酶。別構酶的效應物又稱為變構劑,多為代謝物。
調節方式
 別構調節
別構調節這一調節機制使能量得以有效利用,不致浪費。
這類代謝調節中,負反饋作用更為多見。這是因為過量生成多餘產物,不僅是浪費,且會有害。別構調節還使不同代謝途徑相互協調。
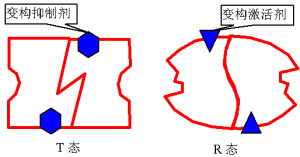
關於效應物如何引起酶活性的變化,所知不多,但可以認為效應物與別構酶的特定部位(別位)以非共價鍵結合後,使酶蛋白的立體結構發生變化,出現次級鍵的改變,或同時引起亞基之間締合狀態的變化,這一構象變化如有利於酶的催化部位發揮作用,則引起酶的活化;如妨礙其發揮作用,則引起酶活性的抑制。
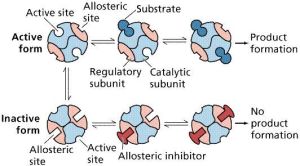
不同的別構酶,具體變構方式可有所不同。有的別構酶,其催化亞基不必與調節亞基分離,即可呈現活性;而另一些別構酶,其催化亞基須與調節亞基分離,方顯活性。
組成
別構酶由一個以上亞基構成,所以是寡聚酶。這種寡聚酶如上述A激酶,由催化亞基與調節亞基組成。催化亞基具有與作用物的結合位點,而調節亞基具有與變構劑非共價結合的特定位點。
但個別別構酶,如依賴cGMP的蛋白激酶,其催化部位與調節部位處於同一亞基。不少別構酶的作用物即是其活化的變構劑。
例如,乙醯CoA是乙醯CoA羧化酶的活化變構劑。反之,反應產物或代謝終末階段產物,常是別構酶的變構抑制劑。例如,6磷酸葡萄糖可變構抑制己糖激酶,葡萄糖可反饋抑制糖原磷酸化酶等。
催化反應
別構酶所催化的反應,其反應動力學不符合米-曼二氏方程式,低濃度的作用物即對反應速度有很大影響。體內的代謝物(作用物)濃度一般較低,即使如此,其濃度稍有變化,即可能對反應速度產生很大影響。達到最大反應速度一半時的作用物濃度,在別構酶不稱為Km,而改稱K0.5s。
生理意義
別構作用具有重要的生理意義,其中以變構酶和配體門控型離子通道受體的別構調節最為典型及熟知。機體生化反應中的關鍵酶大多是變構酶,其別構效應在細胞快速調節中占有極為重要的地位。
G蛋白偶聯受體(GPCRs)介導多數激素及神經遞質的細胞信號轉導,同時也是最重要的藥物作用靶點。相對於正位作用,對GPCRs別構調節具有能夠達到高選擇性、模擬生理性調製受體以及不易過度激活受體的特點而受到關注,A、B、C三族GPCRs均有別構調節劑被發現,有些已被用於臨床。隨著GPCRs別構理論研究的深入,若在別構調節劑開發策略指導下進行定向篩選和結構改造,獲得更有前途的治療藥物。