共雷射掃描共聚焦顯微鏡(Laser scanning confocal microscope,LSCM)是一種先進的分子生物學和細胞生物學研究儀器。它在螢光顯微鏡成像的基礎上加裝雷射掃描裝置,結合數據化圖像處理技術,採集組織和細胞內螢光標記圖像,在亞細胞水平觀察鈣等離子水平的變化,並結合電生理等技術觀察細胞生理活動與細胞形態及運動變化的相互關係。由於它的套用範圍較廣泛,已成為形態學、分子細胞生物學、神經科學和藥理學等研究領域中很重要的研究技術。
原理
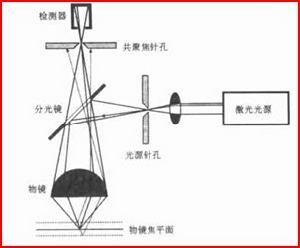
 雷射掃描共聚焦顯微鏡工作原理
雷射掃描共聚焦顯微鏡工作原理構造
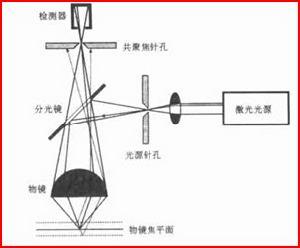
 共聚焦掃描顯微鏡
共聚焦掃描顯微鏡(1)顯微光學系統:
顯微鏡是共焦檢測系統常用的組件,是系統成像質量的核心部分。顯微鏡光路一般採用無限遠光學系統結構,可以方便地在其中插入光學元件而不影響成像質量和測量精度。物鏡應選取大數值孔徑、平場復消色差物鏡,有利於螢光的採集和成像的清晰。物鏡組的轉換、濾色片組的選取、載物台的移動調節、焦平面的記憶鎖定等都可以由計算機自動控制。
(2)掃描裝置:
掃描裝置是雷射共聚焦檢測系統進行大範圍檢測必需的組件,通常有由絲槓導軌組成的XY平移掃描、由陣鏡擺動的掃描等方式。前種掃描方式可以實現大範圍區域的掃描,而後者掃描範圍相對小一些,不過陣鏡擺動掃描可以很快,圖像採集速度可以大大提高,有利於對那些壽命短的離子作螢光測定。掃描系統的工作程式由計算機自動控制,與信號採集相對應。
(3)光源:
光源有單色光(雷射)和多色光(汞燈、氘燈、鹵素燈等)。雷射源可以使用多譜線氬離子雷射器,它提供發射波長為457nm、488nm和514nm的藍綠光;另外,氦氖綠雷射器提供發射波長為543nm的綠光,氦氖紅雷射器提供波長為633nm的紅光。雷射源還可以用其他半導體雷射器。
(4)檢測器:
檢測器通常採用光電倍增管(PMT)、光子計數器等,通過高速A/D轉換器,將信號輸入計算機以便進行圖像重建和分析處理。通常在PMT前設定針孔,可以採用固定大小針孔或由計算機軟體來控制的可變大小針孔。如果是檢測螢光,光路中還應該設定能自動切換的濾色片組,滿足不同測量的需要;也可以採用光柵或稜鏡分光然後進行光譜掃描。
(5)套用軟體系統:
套用軟體系統可以根據具體需要設定各種功能,但有一點是共同的,就是將掃描位置坐標與檢測器接收的信號一一對應起來,並以圖像的方式進行儲存與顯示。
發展
共焦顯微鏡從產生至今獲得了巨大的發展,掃描方式從最初的狹縫掃描方式(掃描速度較快,圖像解析度不高),到階梯式掃描技術(提高了圖像解析度,標本製備要求太高),再到驅動式光束掃描器(掃描速度較快,符合共聚焦原理)。另外,目前雷射掃描共聚焦顯微鏡的光源設計和分光採集技術也有較大的改進,主要集中在如下幾個方面:
(1) 現代的雷射掃描共聚焦顯微鏡可以根據研究需要選擇不同的雷射器。選擇雷射光源時,一方面要滿足研究工作對波長的需求,另一個方面要考慮到雷射光源的壽命。
(2)最新一代雷射掃描共聚焦顯微鏡可以用稜鏡狹縫分光的新技術,配上合適的雷射源後,能夠擺脫傳統的波長濾片組的限制,連續和自由地選擇最佳波長。
(3)用於雷射掃描共聚焦顯微鏡的物鏡也做了較大的改進,不但具有平場復消色差特性,而且能與高速掃描功能相匹配。
共焦顯微鏡發展至今又產生了新的類型,如針孔陣列盤式雷射共聚焦顯微鏡和雙光子共聚焦顯微鏡:
(1)針孔陣列盤式雷射共聚焦顯微鏡:
針孔陣列盤式雷射共聚焦顯微鏡是為了解決快速變化過程的共聚焦檢測問題而提出的,其核心是雙碟片專利技術,由日本Yokogawa Electric公司發明,包括微透鏡陣列碟片與針孔陣列碟片同步鏇轉。
與常規雷射共聚焦方法不同,針孔陣列盤式雷射共聚焦顯微鏡採用CCD作為探測器,無需載物台進行掃描運動,只要微透鏡陣列碟片與針孔陣列碟片同步鏇轉,就可以對物體進行快速共焦檢測,最高全幅採集幀速度達到1000幀/s,是活細胞在體螢光成像的重要工具。
(2)雙光子共聚焦顯微鏡:
 雙光子共聚焦顯微鏡
雙光子共聚焦顯微鏡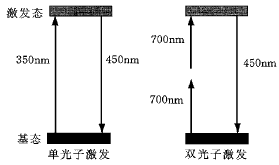 雙光子激發原理
雙光子激發原理雙光子共聚焦顯微鏡有很多優點:1)長波長的光比短波長的光受散射影響較小容易穿透標本;2)焦平面外的螢光分子不被激發使較多的激發光可以到達焦平面,使激發光可以穿透更深的標本;3)長波長的近紅外光比短波長的光對細胞毒性小;4)使用雙光子顯微鏡觀察標本的時候,只有在焦平面上才有光漂白和光毒性。所以,雙光子共聚焦顯微鏡比普通共聚焦顯微鏡更適合用來觀察厚標本、活細胞,或用來進行定點光漂白實驗。
套用
共聚焦顯微鏡有較高的解析度,而且能觀察到樣本隨時間的變化。因此,共聚焦顯微技術在生物學研究領域起著不可或缺的作用。以下為共焦顯微技術的幾個主要套用方面:
(1)組織和細胞中螢光標記的分子和結構的檢測:
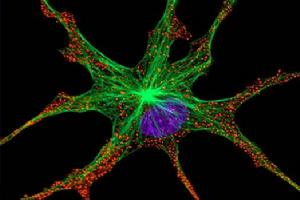 共焦顯微鏡下螢光標記的神經元
共焦顯微鏡下螢光標記的神經元(2)定量或半定量測量Ca2+和pH等細胞內離子濃度及變化:
雷射掃描共聚焦顯微鏡可以提供更好的亞細胞結構中鈣離子濃度動態變化的圖像,這對於研究鈣等離子細胞內動力學有意義。最好與電生理等技術相結合來觀察離子變化與電生理學指標的相關性。
(3)螢光光漂白及恢復技術:
利用高能量雷射束將細胞內某一部分中選定靶區域的某種螢光淬滅,然後觀察鄰近相同的螢光標記物重新擴散入該區域的速度和方式,從而分析細胞內蛋白質運輸、受體在細胞膜上的流動和大分子組裝等細胞生物學過程。
(4)長時程觀察細胞遷移和生長:
目前雷射掃描共聚焦顯微鏡的軟體一般均可自動控制地進行定時和定方式的雷射掃描,而且由於新一代雷射掃描共聚焦顯微鏡的探測效率的提高,只需要很小的雷射能量就可以達到較好的圖像質量,從而減小了每次掃描時雷射束對細胞的損傷,因此,可以用於數小時的長時程定時掃描,記錄細胞遷移和生長等細胞生物學現象。
(5)其他的生物學套用:
用高能量雷射束進行細胞損傷和損毀實驗,一般要用紫外雷射束進行細胞損毀;細胞間通訊研究;光解籠鎖活化技術等。