理論基礎
腫瘤免疫治療的理論基礎是免疫系統具有識別腫瘤相關抗原、調控機體攻擊腫瘤細胞的能力。科學家提出了腫瘤-免疫循環的概念來解釋腫瘤抗原啟動免疫反應的過程。
在生長形成腫瘤組織的過程中釋放抗原並被樹突細胞識別是第一步,這種免疫原性信號可能是由癌症細胞死亡釋放的包括促炎細胞因子在內的物質釋放;然後,樹突細胞將捕獲癌症抗原遞呈給T細胞(第二步),激活T細胞,啟動效應T細胞抗癌症特異抗原的反應(第三步);最後,激活的效應T細胞隨血液循環至腫瘤組織(第四步),並在腫瘤組織中浸潤(第五步),特異性地識別(第六步)並殺死腫瘤細胞(第七步)。這些死掉的腫瘤細胞又釋放了癌症細胞抗原,增加免疫反應的強度。這是一個簡化的理想模型,實際上,腫瘤抗原可能並不會被免疫系統察覺到,樹突細胞和T細胞可能會將腫瘤細胞認為是自體細胞(實際上也是突變了的自體細胞)而不會引發效應T細胞反應,T細胞也可能沒法正確找到腫瘤組織,也可能在浸潤腫瘤組織這一步遭到阻礙,又或者(也是最重要的)即便浸潤了腫瘤組織,腫瘤微環境也可能通過各種手段來抑制這些效應T細胞發揮作用。
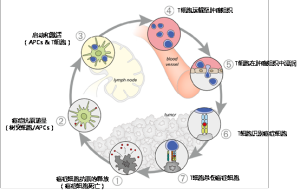 圖1. 癌症免疫循環,改編自Oncology Meets Immunology : The Cancer-Immunity Cycle。
圖1. 癌症免疫循環,改編自Oncology Meets Immunology : The Cancer-Immunity Cycle。癌症免疫治療的目標就是啟動自維持的癌症免疫循環,使其擴增和傳播,但又不能強烈至產生不受控的自身免疫反應。因此我們必須嚴謹巧妙地設計免疫治療的手段,克服種種不能識別的問題和負反饋機制,擴增整個腫瘤-免疫循環,但又不對正常組織造成損傷。目前已經批准上市的藥物或者是正在研究中的疫苗、藥物、細胞療法,都是以此免疫應答機制為理論基礎,在下面的段落中會具體介紹。
種類
治療性抗體
治療性抗體是在實驗室設計合成的能夠摧毀癌症細胞的抗體。有一類治療性抗體稱為抗體藥物複合體(antibody-drugconjugates,ADCs),FDA已經批准了幾種ADC治療不同的癌症。ADC是將抗體和細胞毒藥物或者有放射活性的藥物連線在一起的複合物,抗體使得ADC連線到癌症細胞表面的靶向分子,一旦連線,細胞毒藥物或者有放射活性的藥物將殺滅腫瘤細胞。FDA批准的幾種ADC藥物有:Ado-trastuzumabemtansine(Kadcyla),Brentuximabvedotin(Adcetris)和Ibritumomabtiuxetan(Zevalin)。其他的治療性抗體不攜帶毒性藥物,有些抗體能夠誘導癌症細胞凋亡,有些抗體連線到癌症細胞,這些抗體能夠被免疫系統識別,引起癌症細胞的死亡(通過抗體依賴的細胞介導的細胞毒性作用ADCC或者補體依賴的細胞毒性作用CDC)。有時候這幾種機制同時存在。免疫檢查點抑制劑
癌症細胞包含大量的體突變,這些突變導致蛋白表達的改變,可能會被免疫系統認為是外來抗原進而啟動免疫反應。儘管在動物模型和患者身上可以觀察到內源性的抗腫瘤免疫反應,但這種免疫反應並不足以對抗癌症,因為腫瘤細胞可以引發腫瘤特異T細胞的免疫耐受。免疫檢查點抑制劑即基於此而設計,阻斷由癌症細胞發出的免疫抑制信號。目前FDA批准了三種免疫檢查點抑制劑,Ipilimumab(Yervoy)針對CTLA-4,Nivolumab(Opdivo)和pembrolizumab(Keytruda)針對PD1。CTLA-4和PD1同為免疫哨卡,但在不同地方站崗。CTLA4的崗位設在淋巴結,即癌症-免疫循環的第三部,類似情報人員存在的樹突細胞將捕獲的情報(癌症抗原)交給T細胞,以激活T細胞使其成為有殺傷力的軍方即效應T細胞。而CTLA4就是抑制這個情報傳遞過程的敵情甄別人員,CTLA4的內源性配體表達於樹突細胞表面,一旦與CTLA4結合,就阻止了T細胞的激活。Ipilimumab作為抗CTLA4抗體,攔住了敵情甄別人員喊停免疫反應,使T細胞正常地激活。PD1的崗位設在腫瘤組織,即癌症-免疫循環的第七步,這裡是免疫系統和癌症對抗的戰場,研究提示癌症-免疫循環在進行到這一步之前往往都是順利的,但卻可能會被PD-L1和PD1的結合阻止,抗PD1或者抗PDL1的抗體能夠阻止PD1與PDL1結合,接觸這種抑制,使得T細胞可以順利殺傷癌症細胞。
癌症疫苗
治療性疫苗通常是從患者的癌症細胞或者癌症細胞合成的物質出發進行設計,使得樹突細胞負載上腫瘤特異的抗原遞呈給宿主T細胞,進而將T細胞激活,引發免疫應答。癌症細胞可以通過創造一個抑制免疫反應的微環境來引發免疫耐受,要打破免疫耐受,就要尋找高質量的抗原即給情報人員提供準確的情報,再用上合適的聯合用藥,使得這些抗原順利地誘導免疫系統攻擊攜帶同樣抗原的腫瘤細胞。然而目前為止不論是使用單一抗原(例如MAGE-A3用於非小細胞肺癌),還是腫瘤細胞裂解物(例如GVAX),都沒有取得成功。樹突細胞是最主要的抗原遞呈細胞,癌症疫苗的另一個研發思路就是DC疫苗。目前全球唯一批准上市的治療性疫苗Sipuleucel-T(Provenge)就是DC疫苗。從患者的外周血單核細胞中提取樹突細胞,負載上前列腺癌特異的抗原,回輸至患者體內。患者的中位生存期延長了4個月。但是臨床試驗並沒有顯示出腫瘤縮小或疾病反應率的提升。並且鑒於方法較複雜也並沒有被廣為使用。
溶瘤病毒
溶瘤病毒並不是一種新型治療方法,對病毒治療癌症的研究已經有上百年的歷史,卻長久以來都沒實現以毒攻毒的效果,直至人們可以使用基因工程對病毒進行改造,溶瘤病毒療法才有了新的希望。目前FDA批准上市的溶瘤病毒只有一種,即在2015年10月27日批准上市的lmlygic(Talimogenelaherparepvec),也稱為T-VEC,是一種經過基因改造的單純皰疹病毒,用於皮膚及淋巴結黑色素瘤的治療,T-VEC隨後也被歐盟批准上市。一項在436位不可切除的黑色素瘤患者中的III期臨床試驗顯示,接受Imlygic治療的研究受試者有16.3%的人其皮膚及淋巴結中黑色素瘤病灶減小,並且這種減小持續至少6個月,相比之下,接受對照藥物治療的受試者中有2.1%的人達到這一標準。溶瘤病毒被認為通過兩種機制發揮作用,一是選擇性地感染腫瘤細胞而導致腫瘤細胞的裂解破碎死亡,二是誘導系統性的抗腫瘤免疫反應。
細胞治療
在沒有外界干預的情況下,人體內可以識別腫瘤細胞的T細胞數目是非常非常少的,在多達10的10次方數量級的T細胞中,能識別腫瘤細胞的也就幾千個,通過以往免疫調節的手段可能也只能達到10的5次方的數量級。所以正常情況下,儘管人體記憶體在識別腫瘤的T細胞,但也沒有引起明顯的生物學效應,原因是數目太少。細胞治療就是要解決這個問題。細胞治療目前還是一種實驗性的治療技術,稱為過繼細胞轉移(adoptivecelltransfer,ACT)。在一些小型的臨床試驗中,一些患有晚期癌症的患者(主要是血液腫瘤)通過ACT療法之後腫瘤徹底消失了。某些患者的治療效果已經持續了好幾年。
ACT的一種方式,就是從腫瘤中提取腫瘤浸潤淋巴細胞(tumor-infiltratinglymphocytes,TILs),通過實驗室檢測挑選出最能識別患者腫瘤細胞的TIL進行擴增,然後用免疫系統信號蛋白(即細胞因子)將其激活以後回輸入患者體內。這種方法的一個前提條件是TILs已經有識別腫瘤細胞的能力,只不過在腫瘤微環境中,TIL的數目以及識別能力還不夠,不足以消滅腫瘤細胞,或者戰勝微環境中的免疫抑制信號。而通過體外擴增並激活的方式可以跨越這些障礙進而達到消除腫瘤的目的。
另一個被廣泛研究的ACT的方式是CAR-T細胞治療。從患者血液中提取T細胞,將其進行修飾,使其表達一種稱為嵌合抗原受體(chimericantigenreceptor,CAR)的蛋白,擴增之後回輸到患者體內。CAR是一種修飾後的T細胞受體,表達於T細胞表面。這些受體能夠將T細胞連線到癌症細胞表面,一旦連線,這些T細胞就會被激活進而攻擊癌症細胞。
免疫系統調節劑
還有一類免疫治療是調節免疫系統活性的蛋白,包括細胞因子和某些生長因子。兩種常用於癌症治療的細胞因子是白介素和干擾素。免疫調節劑可能通過多種不同的機制發揮作用。例如,干擾素可以激活包括自然殺傷細胞和樹突細胞在內的白細胞,進而增強免疫系統對癌症細胞的殺傷能力。
典型案例
卡特總統與KeytrudaEmily與CAR-T
療法
(美國)食品藥品管理局已經認可免疫療法可以治療某些癌症。得到認可的免疫療法包括:卡介苗(BCG)、細胞因子α型干擾素和2型白細胞間介素,以及針對淋巴瘤的單克隆抗體和針對晚期或轉移性乳癌的單克隆抗體。許多其它的免疫療法的結果也不錯,現正在進行第Ⅰ階段、第Ⅱ階段和第Ⅲ階段的臨床試驗。惡性黑素瘤
α型干擾素(IFN-α)和2型白細胞間介素(IL-2)已被認可用來治療轉移性惡性黑素瘤。雖然單獨使用非特異性免疫系統刺激物BCG不能延長生命和延緩癌症復發,但是有時把它同惡性黑素瘤疫苗和其它免疫療法聯合使用。最新的臨床試驗結果顯示:某些自體固有或同種異體的腫瘤細胞疫苗和抗原疫苗可以延長一些病人的生命。
腎臟細胞癌(腎癌)
2型白細胞間介素(IL-2)和α型干擾素(IFN-α)是針對轉移性腎臟細胞癌的標準的治療方法。最新研究表明,聯合使用IL-2、IFN-α和化療的效果也不錯。現在,研究人員開始研究DNA疫苗。他們把基因(一段DNA)注入病人的癌細胞,使癌細胞產生細胞因子。細胞因子使免疫系統更好地識別癌症細胞,同時激活免疫系統細胞來對抗癌細胞。這些腫瘤中的免疫系統細胞叫做腫瘤滲透淋巴細胞。淋巴瘤、骨髓瘤和白血病
α型干擾素常常用於治療粒細胞白血病(HCL)、慢性骨髓白血病(CML)、卵泡淋巴瘤、多發性骨髓瘤和影響皮膚的T細胞淋巴瘤。乳癌
單克隆抗體trastuzumab是美國食品藥品管理局批准的,可用於治療中晚期乳癌。目前,乳癌的生物免疫治療主要作為放療和乳房切除手術的一種輔助療法,有時也與激素療法或化療並用。前列腺癌
現在研究的大多數前列腺癌免疫治療都集中在疫苗上。研究人員從病人的血液中取出叫做樹狀細胞的免疫系統細胞,用取自病人前列腺癌細胞的抗原培養。樹狀細胞就能更好地識別並幫助攻擊癌細胞。單克隆抗體和細胞因子也正用於臨床試驗。結直腸癌
左鏇咪唑(一種非特異性免疫系統刺激物)經常與化療藥物5-FU並用,作為輔助治療。某些癌胚抗原(CEA)疫苗提高了很多結直腸癌病人的免疫反應。子宮頸癌
免疫治療在子宮頸癌的治療中屬輔助療法。研究人員正在進行人類乳頭瘤病毒(HPV)疫苗治療子宮頸癌的臨床試驗。他們發現:疫苗產生免疫反應,可以殺死癌細胞或抑制它們的生長。卵巢癌
醫生把2型白細胞間介素(IL-2)直接注射進卵巢癌病人的腹腔,可以提高手術治療後的緩解效果。癌症疫苗和單克隆抗體是治療卵巢癌的新免疫療法。最新研究
20世紀80年代以來,以美國和日本為首的科學家對舞茸(Maitake,又名灰樹花)的研究取得了突破性進展,給癌症患者帶來了全新的治療手段,取得了較為理想的效果。舞茸中含有以β-(1-6)結合為主鏈β-(1-3)結合為側鏈的葡聚糖和以β-(1-3)結合為主鏈β-(1-6)結合為側鏈的活性葡聚糖,實驗證明這些活性葡聚糖可通過活化免疫功能而顯著抑制腫瘤的生長;同時還發現純化的活性葡聚糖只有通過注射才能顯效,而舞茸D-fraction(活性葡聚糖和蛋白的結合物)通過口服便可得到理想的效果。舞茸D-fraction無論是化學結構和組成成分或是分子量都有別於從香菇、雲芝、靈芝、等其他菇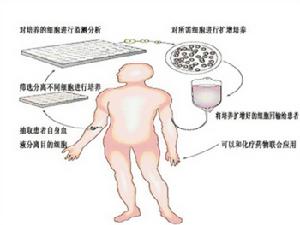
動物實驗和臨床實驗顯示舞茸D-fraction是通過以下幾個方面來發揮防癌抗癌作用:
1、活化吞噬細胞、自然殺手細胞、傷害性T細胞等免疫細胞,誘導白細胞素,干擾素-γ,腫瘤壞死因子-α等細胞因子的分泌。
2、誘導癌細胞凋亡。
3、與傳統的化學治療藥物(絲裂黴素、卡莫斯丁等)合用,既增加藥效,又減輕化療過程中的毒副作用。
4、與免疫治療藥物(干擾素-α2b)有協同作用。
展望
癌症治療以往的策略都是專注於直接攻擊腫瘤細胞,而旨在通過人體免疫系統達到攻擊腫瘤目的的免疫治療已經成為傳統治療方法之外的新手段。尤其是CTLA-4和PD1藥物的成功更是大大促進了免疫治療的發展,新的治療靶點和新的聯合用藥方案都是當下研究的熱點。ACT也在血液腫瘤中取得了引人矚目的試驗結果,我們預期在不遠的將來這種方法就會成為相當一部分腫瘤患者的標準治療。
藥物
目前免疫治療藥物尚未在中國上市,如果了解使用,請您去美國、新加坡當地醫院進行諮詢。
| 藥物 | 商品名 | 適應症 |
| Nivolumab (納武單抗) | Opdivo | 1.單藥用於經Ipilimumab治療後疾病進展的無法手術切除或轉移性黑色素瘤,如BRAFV600突變陽性,則使用BRAF抑制劑;與Ipilimumab聯合用於BRAF野生型,不能手術切除或轉移的黑色素瘤 2.經鉑為基礎化療期間或化療後疾病進展的轉移性非小細胞肺癌,若有EGFR或ALK突變,則要先經EGFR或ALK靶向治療 3.接受過抗血管新生治療的晚期腎細胞癌 |
| Pembrolizumab | Keytruda | 1.不可切除或轉移性黑色素瘤 2.腫瘤表達PD-L1的經鉑為基礎的化療期間或化療後疾病進展的轉移性非小細胞肺癌,若有EGFR突變或ALK基因重排應先進行相應的靶向治療 |
| Ipilimumab | Yervoy | 不能手術切除的或轉移性晚期黑素瘤 |

