導語
顧名思義,價化合物就是符合原子價規則的化合物,也就是正負離子間通過電子的轉移(離子鍵)和(或)電子的共用(共價鍵)而形成的穩定的8電子組態ns2np6的化合物。
正文
按照結合鍵的性質,價化合物可分為離子化合物、共價化合物和離子-共價化合物。在離子-共價化合物中,價電子既沒有從正離子轉到負離子,也不是位於兩種離子的中間位置,而是偏向於(或更接近於)一種離子。
按照價電子是否都是鍵合電子,又可將價化合物分為正常價化合物和一般價化合物,前者的價電子都是鍵合電子,後者只有部分價電子是鍵合電子。因此,對於化學式為CmAn的正常價化合物,由於m個陽離子(正離子)C的價電子數必須恰好補足n個陰離子(負離子)A的8電子層,故有:mec=n(8-eA)。式中eC和eA分別是非電離態的C和A的價電子數。該式就是正常價化合物的價電子方程,它決定了正常價化合物可能的m、n值。對於化學式為CmAn的一般價化合物,由於m個陽離子提供給n個陰離子的鍵合電子數必須等於n個陰離子為補足成8電子層所需要的電子數,故其價電子方程應為:m(eC-eCC)=n(8-eA-eAA)。式中eCC是留在每個陽離子上的平均價電子數,包括非鍵合電子和形成C-C鍵的電子,它們是不形成C-A鍵的。eAA則是每個陰離子由於陰離子之間形成共價鍵而獲得的平均價電子數,這些價電子也是不參與C-A鍵的。
正常價化合物只是一般價化合物的特殊情形,即eAA=eCC=0的情形。若化合物中eCC很大,則稱為多陽離子化合物。若eAA很大,則稱為多陰離子化合物。
應該指出,價化合物,特別是正常價化合物,和離子化合物之間並無截然的界限。可以認為,具有正常價的金屬間化合物包括除金屬鹵化物和氧化物以外的一切離子化合物。因此,正常價化合物的結構也就包括了各種典型離子化合物的晶體結構。表2-14分別列舉了NaCl,CaF2,反CaF2,閃鋅礦和纖鋅礦結構的各種正常價化合物。其中值得注意的是具有閃鋅礦和纖鋅礦結構的化合物。人們發現,按照缺陷情況,這些化合物又可進一步分為具有正常四面體結構的化合物和具有缺位四面體結構的化合物。前者的特點是:(1)每個原子的平均價電子數為4;(2)每個原子被4個位於四面體頂點的最近鄰異類原子包圍,而所論原子則位於四面體中心。後者的特點是(1)每個原子的平均價電子數大於4;(2)每個原子的最近鄰電子數少於4,因而有的四面體頂點是空著的(缺位)。表2-14中列舉的閃鋅礦和纖鋅礦結構的化合物都是正常四面體結構的化合物。
關於正常價化合物的形成規律,Hume-Rothery指出了兩點:(1)所有金屬一般都傾向於與IVB、VB和VIB族元素形成正常價化合物。(2)金屬的正電性越強或B族元素的負電性越強,上述傾向性就越大,而且化合物也越穩定。以金屬Mg和IVB、VB和VIB族元素X形成的正常價化合物Mg2(Si,Ge,Sn或Pb)、Mg3(P,As,Sb或Bi)、Mg(S,Se或Te)為例,實驗發現,在Mg和同族元素形成的化合物中,X的原子序數越大,化合物的熔點越低,而在Mg和同周期元素形成的化合物中,X的原子序數越大,化合物的熔點越高。由此可見,金屬元素M(這裡是Mg)和B族元素的負電性差越大,它們形成的正常價化合物就越穩定。
 表2-14 各種正常價化合物的結構
表2-14 各種正常價化合物的結構由於價化合物的結合鍵主要是離子鍵和(或)共價鍵,故這類化合物主要呈現非金屬性質或半導體性質。
在價化合物中還要提到一種邊緣(或過渡)狀態的化合物,即砷化鎳(NiAs)結構,它的結合鍵和性質都介於典型的價化合物和典型的金屬間化合物(如電子化合物)之間。
砷化鎳結構往往是由過渡族金屬Cr,Mn,Fe,Co,Ni,(Cu),(Pd),(Pt)與準金屬S,Se,Te,As,Sb,Bi(有時也與Ge及Sn)形成的合金。準金屬原子形成密排六方結構,而過渡族金屬原子則位於其八面體間隙中(這些金屬原子本身形成一簡單六方結構)。兩類原子分層排布,形成所謂層狀結構。
按照上述結構模型,砷化鎳結構的化學式應該都是AB(A為金屬,B為準金屬)。大多數具有砷化鎳結構的化合物都是AB型,如表2-15所示。然而實驗發現,這些化合物往往有一定的成分範圍,即A,B原子數之比不是嚴格的1:1。例如,在NiSb中Ni原子含量可能在46.4%(摩爾分數)到54.4(摩爾分數)之間。當Ni原子未填滿八面體間隙時,含Ni量就低於50%(摩爾分數);當Ni原子不僅填滿了八面體間隙,而且還有些Ni原子填入三角形間隙時,含Ni量就高於50%(摩爾分數)。由此可見,在砷化鎳結構中,金屬分點陣(A分點陣)可以是有缺陷的------有空位或間隙原子,而準金屬分點陣(B分點陣)則是完整的。又如,在FeSb(含Fe為52%~58%(摩爾分數))和CoSb(含Co為50.8%~56.4%(摩爾分數))結構中都具有過剩的“間隙式”過渡族金屬原子,它們彼此還可形成連續固溶體。
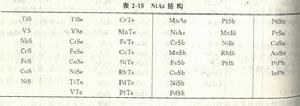 表2-15 NiAs結構
表2-15 NiAs結構在某些具有砷化鎳結構的化合物中,過渡族金屬A的分點陣中的缺陷是如此之多,以致其化學式不能再用AB表示,而應寫成AmBn,這裡m可大於或小於n,視準金屬而定。隨著B組元(準金屬)外層電子數(或族數)減小,結構便從缺陷型(相當於B過剩)變為間隙型(A過剩),這表明,當B組元外層電子減少時,就需要由更多的A組元來提供電子,以維持結構的穩定性。例如,當B組元是VB族元素時,化學式通常是AB(當然成分可有偏離),但當B是IIIB或IVB族元素時,化學式就可以是AB2(如CoTe2和NiTe2)。它們都不再是層狀結構了。
在砷化鎳型結構中,金屬A與準金屬B原子間的結合鍵是離子鍵,而A與A之間是金屬鍵。兩種鍵的相對強度取決於準金屬的性質(負電性大小)和化合物的成分。
隨著組元(特別是B組元)的不同,不僅化合物的成分和化學式可以在很寬的範圍內變化,其性能、結合鍵和軸比(c/a)也可以在很寬的範圍內變化。表2-15中按照c/a遞減的順序列舉了一些具有砷化鎳結構的化合物。從表看出,隨著準金屬的負電性減小(或正電性增大),離子鍵減弱而金屬鍵增強,因而金屬性增強,軸比c/a不斷減小(在離子鍵為主的NiS中由於負離子要密排,所以c/a達到1.633)。這就是為什麼人們將砷化鎳看成是由非金屬化合物到金屬間化合物之間的過渡(或邊緣)結構。事實上,有人乾脆將它看成是電子濃度(e/a)為5/2的電子化合物,但其中過渡族金屬的價並不總是零。例如,在NiSb中Ni的原子價為0,但在Nisn和NiS中Ni的原子價分別取為+1和-1。
相關詞條
陽離子 陰離子 離子鍵

