定義
主量子數只能取正整數的值。當主量子數增加時,原子軌道變大,原子的外層電子將處於更高的能量值(能量值只能取確定的、分離的值,這些能量值稱為能級),因此受到原子核的束縛更小。這是波爾模型引入的唯一一個量子數。
主量子數n是用來描述原子中電子出現幾率最大區域離核的遠近,或者說它是決定電子層組數的。因為電子排布遵循最低能量原理排布順序為ns→(n-2)f→(n-1)d→np,故當主量子數等於3時能級排到1s2s2p3s3p3d。
 原子電子分布圖
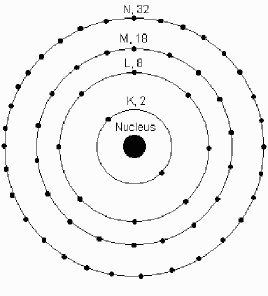
原子電子分布圖n相同的電子為一個電子層,電子近乎在同樣的空間範圍內運動,故稱主量子數。
主量子數的n的取值為1,2,3...等正整數。例如,n=1代表電子離核的平均距離最近的一層,即第一電子層;n=2代表電子離核的平均距離比第一層稍遠的一層,即第二電子層。余此類推。
可見n愈大電子離核的平均距離愈遠。
在光譜學上常用大寫拉丁字母K,L,M,N,O,P,Q代表電子層數。
主量子數(n)1 2 3 4 5 6 7
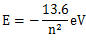 主量子數
主量子數電子層符號K L M N O P Q主量子數n是決定電子能量高低的主要因素。
對單電子原子來說:
n值愈大,電子的能量愈高。例如氫原子中電子的能量完全由主量子數n決定:公式見右圖。
對多電子原子來說:
核外電子的能量除了同主量子數n有關以外還同原子軌道(或電子云)的形狀有關。
因此,n值愈大,電子的能量愈高這句話,只有在原子軌道(或電子云)的形狀相同的條件下,才是正確的。
主要作用
決定原子中電子的能量及與核的平均距離(一般能量低的趨向近軌道,r較小,反之則反),即表示電子所處的量子殼層。如K、L、M…,n=1,2,3。
相關關鍵字
量子力學,量子基金,量子膜