結構和化學鍵
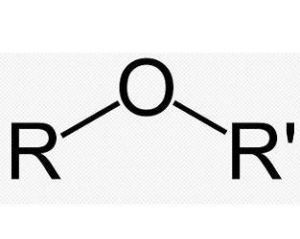 醚
醚醚的結構通式為:R-O-R(R')、Ar-O-R或Ar-O-Ar(Ar')(R=烴基,Ar=芳烴基)。醚的鍵角約為110°,C-O鍵長為140pm,C-O鍵的鏇轉能壘的能量很小,而水、醇與醚分子中氧的鍵合能力也與此相似。根據價鍵理論,氧原子的雜化狀態是sp3。
氧原子的電負性比碳更強,因此與氧連線的α氫原子酸性強於碳連線的α氫原子,然而其酸性比不上羰基α氫原子。
命名
醚的普通命名法是於烴基後加上“醚”字,習慣上對稱醚的“二”字可省略。醚的兩個不同基團排列順序通常是:先小基團後大基團。芳香醚的命名習慣則為:苯基或芳烴基在前。英文命名則按字母順序。冠醚的命名為 x-冠-y,x代表環總原子數,y代表環中氧原子數。
醚的分類
兩個烴基相同的醚成為對稱醚,也叫簡單醚。兩個烴基不相同的醚稱為不對稱醚,也叫混合醚。
| CH3—O—CH3 | CH3—O—CH2CH3 |
| 對稱醚 | 不對稱醚 |
根據兩個烴基的類別,醚還可以分為脂肪醚和芳香醚。
| CH3CH2OCH2CH3 |  芳香醚 芳香醚 |  芳香醚 芳香醚 |
| 脂肪醚 | 芳香醚 | 芳香醚 |
在脂肪醚中,分子中不是由氧原子和碳原子結合成環狀醚結構的醚稱為無環醚。還可細分為飽和醚和不飽和醚。有氧原子和碳原子結合成環狀醚結構的醚
稱為環醚。環上含氧的醚稱為內醚或環氧化合物。含有多個氧的大環醚因形如皇冠稱之為冠醚。例如:
| CH3CH2OCH(CH3)2 | CH2=CH—O—CH3 | |
| 飽和醚(無環醚) | | 不飽和醚(無環醚) |
 環醚是氧原子和碳原子成環 環醚是氧原子和碳原子成環 |  |  冠醚 冠醚 |
| 環醚 | 環氧化合物 | 冠醚 |
命名
一般醚以與氧相連的烴基加醚字命名,例如,C2H5─O─C2H5稱二乙基醚,簡稱乙醚,CH3─O─C2H5稱甲基乙基醚,簡稱甲乙醚。環醚一般用俗名。
物理性質
多數醚是易揮發、易燃的液體。與醇不同,醚分子之間不能形成氫鍵,所以沸點比同組分醇的沸點低得多,如乙醇的沸點為78.4℃,甲醚的沸點為-24.9℃;正丁醇的沸點為117.8℃,乙醚的沸點為34.6℃。常用醚的沸點如下表所示。
| 化合物 | 沸點/℃ | 相對密度 |
|---|---|---|
| 甲醚 | -24.9 | 0.661 |
| 甲乙醚 | 7.9 | 0.697 |
| 乙醚 | 34.6 | 0.714 |
| 正丙醚 | 90.5 | 0.736 |
| 正丁醚 | 143 | 0.769 |
| 甲丁醚 | 70.3 | 0.744 |
| 乙丁醚 | 92 | 0.752 |
| 乙二醇二甲醚 | 83 | 0.862 |
| 四氫呋喃 | 65.4 | 0.888 |
| 1,4-二氧六環 | 101.3 | — |
| 環氧乙烷 | 11 | — |
| 1,2-環氧丙烷 | 34 | — |
| 1,2-環氧丁烷 | 63 | — |
| 順-2,3-環氧丁烷 | 59 | — |
| 反-2,3-環氧丁烷 | 54 | — |
多數醚不溶於水,但常用的四氫呋喃和1,4-二氧六環卻能和水完全互溶,這是由於二者和水形成氫鍵。乙醚的碳氧原子數雖然和四氫呋喃的相同,但因後者的氧和碳架共同形成環,氧原子突出在外,容易和水形成氫鍵,而乙醚中的氧原子“被包圍”在分子之中,難以和水形成氫鍵,所以乙醚只能稍溶於水。在室溫下,乙醚中可溶有1%~1.5%的水;水中可溶解7.5%的乙醚。由於二者相互溶解很少,而多數有機物易溶於乙醚,故常用乙醚從水中各種提取易溶於乙醚的物質,但醚提取液中會含有少量水,在蒸餾乙醚之前,需要經過乾燥去水,同時,在提取過程中也會損失一部分乙醚。乙醚是實驗室中常用的溶劑,而鹽類化合物在其中不溶,故於鹽類化合物的乙醇溶液中加入乙醚,可從中析出沉澱物——鹽類化合物。乙醚極易揮發、著火,乙醚氣體和空氣形成爆炸性混合氣體,一個電火花即會引起劇烈爆炸。
乙醚是在外科手術中常用的麻醉劑,其作用不是化學性質的,而是溶於神經組織脂肪中引起的生理變化。這種麻醉作用決定於醚在脂肪相和水相中的分配係數。乙烯基醚也是一種麻醉劑,其麻醉性能比乙醚強7倍,而且作用極快,但有迅速達到麻醉程度過深的危險,因而限制了它在這方面的實際套用。
合成
 醚類
醚類醚在實驗室條件下可通過許多方法合成:
醇的脫水
醇可通過脫水反應製備醚:
2R-OH→R-O-R+H2O(高溫下)
該反應過程需要高溫(通常在125°C)。該反應還需要酸的催化(通常為硫酸)。上述方法對於製備對稱醚來說有效,但對於不對稱醚卻無能為力,如:乙醚易於通過此法製備,環醚也同樣可用此方法製備(分子內脫水)。另外此方法還會引入一定的副產物,如分子內脫水產物:
R-CH2-CH2(OH)→R-CH=CH2+H2O
另外此法只能合成一些簡單的醚,對於複雜的分子醚類分子不太適用。對於複雜分子則需要更溫和的條件來合成。
威廉姆遜醚合成
鹵代烴和醇鹽發生親核取代反應:
R-ONa+R'-X→R-O-R'+NaX
該反應稱作:威廉姆遜合成。該反應通過用強鹼處理醇,形成醇鹽,而後與帶有合適離去基團的烴類分子反應。這裡的離去基團包括:碘、溴等鹵素,或磺酸酯。該方法對於芳香鹵代烴一般不適用(如:溴苯,參見Ullmann縮合)。該方法還只局限於一級鹵代烴才可得到較好的收率,對於二級鹵代烴與三級鹵代烴則由於太易生成E2消除產物而不適用。
在相似的反應中,烷基鹵代烴還可與酚負離子發生親核取代反應。R-X雖不能與醇反應,但酚卻能夠進行該反應(酚酸性遠高於醇),它可通過一個強鹼,如:氫化鈉先形成酚負離子再進行反應。酚可取代鹵代烴中的X離去基團,形成酚醚的結構,該過程為SN2機理。
C6H5OH+OH-→C6H5-O-+H2O
C6H5-O-+R-X→C6H5OR
二芳醚合成
Ullmann二芳醚合成的反應很類似於威廉姆遜反應,不同之處在於底物是芳香鹵代烴。該反應需要催化劑才能進行,如:銅。
醇對於烯烴的親電加成反應
醇可與活化後的烯烴進行親電加成:
R2C=CR2+R-OH→R2CH-C(-O-R)-R2
該反應需要酸催化,三氟醋酸汞(Hg(OCOCF3)2)常可作為這種反應的催化劑,反應生成具有弗拉基米爾·瓦西里耶維奇·馬爾科夫尼科夫(Markovnikov)立體化學的醚類。使用相似的反應條件,四氫吡喃醚(THP)可作為一種醇的保護基。
製備環氧化合物
主條目:環氧化合物
環氧化合物通常由烯烴氧化製備。在工業生產中,最重要的環氧化合物是:環氧乙烷,它通過乙烯和氧氣製備。其他的過氧化合物還可通過以下方法製備:
通過過氧酸和烯烴來製備,如:間氯過氧苯甲酸(mCPBA)。
通過鹵代醇分子內的親核取代反應來製備。
醚的結構
脂肪醚中的醚鍵中的氧原子取sp3雜化狀態,兩對孤對電子分占兩根sp3雜化軌道,另外兩根sp3雜化軌道分別與兩個烴基碳的sp3雜化軌道形成σ鍵。其∠COC的鍵角接近111°。例如二甲醚的∠COC為111.7°。
化學性質
自動氧化
 醚
醚乙醚及其他的醚如果常與空氣接觸或經光照,可生成不易揮發的過氧化物(peroxide)。
多數自動氧化是通過自由基機理進行的。
過氧化醚是爆炸性極強的高聚物,蒸餾含有該化合物的醚時,過氧化醚殘留在容器中,繼續加熱即會爆炸。為了避免意外,在使用存放時間較長的乙醚或其他醚如四氫呋喃等之前應先進行檢查,如果含有過氧化物,加入等體積的2%碘化鉀醋酸溶液,會游離出碘,使澱粉溶液變紫色或藍色。三價硫酸鐵和50%硫酸配製的硫酸亞鐵溶液,約加入體積的1/5,並劇烈震盪,可破壞過氧化物。也可用氫化鋰鋁等還原過氧化物。為了防止過氧化物的形成,市售無水乙醚中加有0.05μg/g二乙基氨基硫代甲酸鈉做抗氧化劑。即使乙醚中不含過氧化物,由於乙醚高度揮發及其蒸氣易燃,也常有爆炸和著火的危險,使用時一定要注意及要有預防措施。
形成釒羊鹽
醚由於氧原子上帶有孤電子對,作為一個鹼和濃硫酸、氯化氫或路易斯酸(如三氟化硼)等可形成二級釒羊鹽。
乙醚能吸收相當量的鹽酸氣,形成釒羊鹽,如果與有機鹼如胺的乙醚溶液放在一起,即可析出胺的鹽酸鹽,這是製備胺鹽的一個方法。
如將醚與三氟化硼形成的二級鹽和氟代烷反應,還可以形成三級釒羊鹽。
這種三級鹽極易分解出烷基正離子,並與親核試劑反應,所以,是一種很有用的烷基化試劑。
碳氧鍵斷裂反應
醚與氫碘酸一起加熱,發生的斷碳氧鍵裂,這種斷裂是酸與醚先形成釒羊鹽,然後,隨烷基性質的不同,而發生SNl或SN2反應,一級烷基發生SN2反應,三級烷基容易發生SN1反應,生成碘代烷和醇,在過量的酸存在下,所產生的醇也轉變成碘代烷。
氫溴酸和鹽酸也可以進行上述反應,但因兩者沒有氫碘酸活潑,需用濃酸和較高的反應溫度。
對於混合醚,碳氧鍵斷裂的順序是:三級烷基>二級烷基>一級烷基>芳基。
芳基與氧的孤電子對共軛,具有某些雙鍵性質,因此難於斷裂。ZeiselS(蔡塞爾)的甲氧基(—OCH3)定量測量法,就是以上面的反應為基礎而進行的。天然的複雜有機物分子內,常含有甲氧基。取一定量的含有甲氧基的化合物和過量的氫碘酸同熱,把生成的碘甲烷蒸餾到硝酸銀的酒精溶液里,按照所稱生成的碘化銀的含量,就可計算出原來分子中的甲氧基含量。
環醚與酸反應,使環醚打開,生成,鹵代醇酸過量時,生成二鹵代烷。
不對稱的環醚開環,生成兩種產物的混合物。
鹽酸與四氫呋喃反應時,需加入,無水氯化鋅在過量酸存在下,生成1,4-二氯丁烷,該化合物是制尼龍的重要中間體原料。
開環反應
一般的醚是較穩定的化合物,故常用作溶劑。醚對鹼很穩定,例如,醚與氫氧化鈉水溶液、醇鈉的醇溶液以及氨基鈉的液氨溶液都無反應。但環氧乙烷這類化合物和一般醚完全不同,它不僅可與酸反應,而且反應條件溫和、速度快,同時還能與不同的鹼反應。原因是它的三元環結構使各原子的軌道不能正面充分重疊,而是以彎曲鍵相互連結,由於這種關係,分子中存在一種張力,極易與多種試劑反應,把環打開,在有機合成中非常有用,通過它可以合成多種化合物。
1.酸催化的開環反應
開環反應按SN1或帶有SN1特徵的SN2歷程進行。酸性開環,開環方向:生成穩定碳正離子
乙硼烷與環氧化物開環反應也是酸催化開環,乙硼烷可以看作是甲硼烷的二聚體,硼外層6電子構型,可以與環氧化物中的氧絡合,其作用與質子酸類似,因此硼烷中的負氫轉移到取代基較多的環碳原子上。
2.鹼性開環反應
鹼催化開環主要是試劑活潑,親核能力強,環氧化合物上沒有帶正電荷或負電荷,這是一個SN2反應,C—O鍵的斷裂與親核試劑和環碳原子之間鍵的形成幾乎同時進行,這時試劑選擇進攻取代基較少的環碳原子,因為這個碳的空間位阻較小。
醚的製備
Williamson合成法
Williamson(威廉森)合成法是用醇鈉和鹵代烷在無水條件下的反應。
RONa+R'X—>ROR'+NaX
醇分子間失水
在濃硫酸作用下,由醇可制對稱醚,如:
2ROH—濃H2SO4—>ROR+H2O
烯烴的烷氧汞法—去汞法
這是一個相當於烯烴加醇的制謎方法。反應遵循馬氏規則,但中間要經過加汞鹽(三氟乙酸汞)、再還原去汞的步驟。這和烯烴羥汞化制醇法類似,但比羥汞化反應更容易進行,是一個有用的制謎方法,而且不會發生消除反應,因此,比Williamson合成法更為好用。
不過這個方法不能用於製備三級丁醚,這可能是由於空間位阻的原因。
套用
環氧乙烷套用
環氧乙烷為無色、有毒的氣體,沸點11℃,可與水混溶,可與空氣形成爆炸混合物,爆炸範圍3%~8%,它本身也可用作殺蟲劑。在工業上,它是用乙烯在銀催化作用下用空氣氧化得到的。
環氧乙烷的用途是:
(1)環氧乙烷絕大多數(~70%)用作生產乙二醇,其方法是在加壓或酸催化下與水一起加熱。
乙二醇是制滌綸——聚對苯二甲酸二乙二醇酯的原料。
(2)環氧乙烷在催化劑如四氯化錫及少量水存在下,聚合成聚乙二醇(或稱聚環氧乙烷),聚乙二醇是水溶性的。
聚乙二醇可用作聚氨酯的原料,聚氨酯可制人造革、泡沫塑膠,醫用高分子材料等。
乙烷引發開環聚合,這樣得到的是非離子性的表面活性劑,可用作洗滌劑、乳化劑、分散劑、助溶劑,紡織工業的潤濕劑、勻染劑等。
(4)環氧乙烷可用作有機合成試劑,或用它合成很多溶劑如一縮二乙二醇二甲醚等
環氧丙烷套用
環氧丙烷是無色具有醚味的液體,沸點34℃,在空氣中爆炸極限為2.1%~21.5%(體積),在水中溶解度為40.5%(20℃)。環氧丙烷的生產方法主要用丙烯與次氯酸加成再失水成環。
環氧丙烷的性質與環氧乙烷類似,但反應性稍低,在很多情況下可代替環氧乙烷使用,其主要用途:
(1)生產1,2-丙二醇。
(2)與丁烯二酸酐反應生成不飽和聚酯。
不飽和聚酯可用苯乙烯固化,用於制塑膠(如玻璃鋼)、塗料等。
(3)用於合成聚1,2-丙二醇(或稱聚環氧丙烷)。
聚-1,2-丙二醇與聚乙二醇類似,也可用作聚氨酯的原料,但其硬度較用聚乙二醇的大。
環氧氯丙烷套用
3-氯-1,2-環氧丙烷也稱環氧氯丙烷,是無色液體,沸點116.5℃,3-氯-1,2-環氧丙烷可用於製造環氧樹脂。
其中間過程是酚氧負離子使環氧化物開環,然後再關環。