基本概念
在無機反應中,有元素化合價升降,即電子轉移(得失或偏移)的化學反應是氧化還原反應。在有機反應中,有機物引入氧或脫去氫的作用叫做氧化反應,引入氫或失去氧的作用叫做還原反應。氧化與還原的反應是同時發生的,即是說氧化劑在使被氧化物質氧化時,自身也被還原.而還原劑在使被還原物還原時自身也被氧化。氧化還原反應的特徵是元素化合價的升降,實質是發生電子轉移。
判斷依據
 電子-模型圖
電子-模型圖 即應看其是失去了電子(或電子對偏離),還是得到了電子(或電子對偏向)或者看其化合價是升高了還是降低了。
在反應物中:
失去了電子(或電子對偏離)即為還原劑,其化合價升高。
得到了電子(或電子對偏向)即為氧化劑,其化合價降低。
在產物中:
被氧化的產物叫做氧化產物,其化合價在反應的過程中升高了。
被還原的產物叫做還原產物,其化合價在反應的過程中降低了。
一般來說,在氧化劑、還原劑、氧化產物、還原產物中,氧化劑的氧化性最強,還原劑的還原性最強。可以用來判斷氧化還原反應的發生。
反應類型
氧化還原反應分 歧化反應、歸中反應等類型歧化反應即反應中同一元素從一個價態轉化為兩個價態。一個高價態,一個低價態,也就是說同一物質既做氧化劑又做還原劑。
歸中反應是指同一元素的不同價態升至或降至同一個價態。但要注意符合化合價不能交叉的原理。
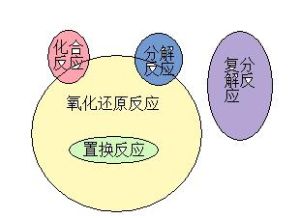
置換反應一定是氧化還原反應,有單質生成的分解反應和化合反應也是氧化還原反應,複分解反應一定不是氧化還原反應。
有單質生成的不一定是氧化還原反應,同素異性體就不是,如石墨(c)在高溫高壓下化學反應生成金剛石(c),化合價沒變,所以不是氧化還原反應。
記憶口訣
升失氧化還原劑,降得還原氧化劑。 升失氧,降得還,劑性正相反
氧化還原不可分,
電子轉移是根本。(電子得失,共用電子兩種情況)
失電子者被氧化,
得電子者被還原。
失電子者還原劑,
得電子者氧化劑。
氧化劑還原劑,
相依相存永不離。
前兩行也可以是:上失氧,下得還
解釋 :化合價上升失電子被氧化,本身作為還原劑;化合價下降得電子被還原,本身作為氧化劑。
升失氧還氧【諧音記憶法:師生還陽】(化合價升高,失去電子,氧化反應,還原劑,被氧化)
降得還氧還(化合價降低,得到電子,還原反應,氧化劑,被還原)
配平化學式
簡單的化學方程式是很容易配平的。但是,有機化合物中原子間一 般都以共價鍵相結合,所以沒有電子得失的問題,在氧化還原反應過程 中化合價不發生變化,因此,反應方程式的配平比較複雜。加之,有機 化學反應的特點之一是副反應多,所以在書寫一個有機化學反應方程式 時,常常只表示它的 反應和主要反應產物,因此在反應物和生成物之 間常用“→”號表示,由此對反應方程式的配平也就不象寫無機化學反 應方程式那么嚴格要求了。我們在一些有機化學書中常見到的化學反應 方程式都不是完全配平的。現在我們從學習了無機化學反應方程式配平 的基礎上,簡單介紹一下有機化合物氧化還原反應方程式的一般配平法。
根據電子得失的個數相等來配平氧化還原反應方程式是無機化合物反應中常用的方法,稱為電子法。在有機化合物的氧化還原反應中較普遍地採用氧化數法來配平。
還原性強弱
物質的氧化性是指物質得電子的能力,還原性是指物質失電子的能力。物質氧化性、還原性的強弱取決於物質得失電子的能力(與得失電子的數量無關)。
從方程式與元素性質的角度,氧化性與還原性的有無與強弱可用以下幾點判定:
(1)從元素所處的價態考慮,可初步分析物質所具備的性質(無法分析其強弱)。最高價態——只有氧化性,如H2SO4、KMnO4中的S、Mn元素;最低價態,只有還原性,如Cl-、S2-等;中間價態——既有氧化性又有還原性,如Fe、S、SO2等。
(2)根據氧化還原的方向判斷:
氧化性:氧化劑>氧化產物;還原性:還原劑>還原產物。
(3)根據反應條件判斷:
當不同的氧化劑與同一種還原劑反應時,如氧化產物中元素的價態相同,可根據反應條件的高、低進行判斷,如是否需要加熱,是否需要酸性條件,濃度大小等等。
需要注意的是,物質的氧化還原性通常與外界環境,其他物質的存在,自身濃度等緊密相關,通過以上比較僅能粗略看出氧化還原性大小。如欲準確定量地比較氧化還原性的大小,需要使用電極電勢。