氧化還原聚合
正文
氧化還原反應所產生的自由基引發烯類單體的聚合(見自由基聚合)。20世紀30~40年代,在德國、美國、英國先後發現氧化還原聚合,當時為了縮短水溶液和乳液聚合反應的誘導期而加入還原劑,結果不僅縮短了誘導期,也提高了聚合速率。以後就將由氧化劑和還原劑組成的引發體系(見自由基聚合引發劑)叫做氧化還原引發體系。由於氧化劑和還原劑之間的單電子轉移引起氧化還原反應而產生自由基,這樣既可以降低過氧化物的分解活化能,在較低溫度(如零度至室溫)條件下引發單體聚合,也可以增加過氧化物的分解速率,從而增加聚合速率。因此,氧化還原聚合具有聚合溫度低和聚合速率快兩個優點。氧化還原引發體系的分類 過氧化氫類與金屬鹽組成的引發體系 過氧化氫的分解活化能Ea很高,為54千卡/摩爾,不適合單獨作引發劑。過氧化氫和金屬鹽的引發體系,如 H2O2-Fe2+體系(又稱芬頓試劑)的分解活化能低,為9.4千卡/摩爾,因此可以在室溫下引發丙烯腈水溶液聚合:
HO—OH─→HO·+·OHEa=54kcal/mol
HO—OH+Fe2+─→HO·+OH-+Fe3+
Ea=9.4kcal/mol
有機過氧化氫物如異丙苯過氧化氫 CHP、對異丙基異丙苯過氧化氫IPCHP、對烷過氧化氫 PMHP分別與亞鐵鹽組成的氧化還原引發體系,都可用作低溫丁苯乳液聚合的引發劑。隨著過氧化氫物的不同,下列引發劑所引發的聚合速率相應遞減:
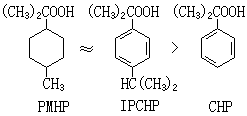
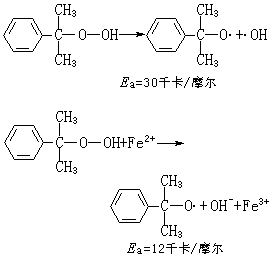
ROOH+Cu+─→RO·+OH-+Cu2+
ROOH+Cu2+─→ROO·+H++Cu+
酮過氧化物與 Co2+鹽組成的氧化還原引發體系可用於不飽和聚酯的室溫交聯固化反應。為了使鈷鹽溶於苯乙烯和不飽和聚酯的混合液中,可採用它的環烷酸或脂肪酸鹽,它們常稱促進劑。常用的酮過氧化物是丁酮過氧化物或環己酮過氧化物,前者是由丁酮和過氧化氫在酸性條件下反應合成的,得到的不是單一結構的過氧化物,因此不同批料的丁酮生產的過氧化物會影響聚合的凝膠化和固化時間。丁酮過氧化物的主要組分有: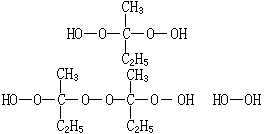
 組成氧化還原引發體系,它們的分解活化能分別為12.0千卡/摩爾和10千卡/摩爾。後者曾用於丙烯腈水溶液的沉澱聚合(見溶液聚合)。
組成氧化還原引發體系,它們的分解活化能分別為12.0千卡/摩爾和10千卡/摩爾。後者曾用於丙烯腈水溶液的沉澱聚合(見溶液聚合)。 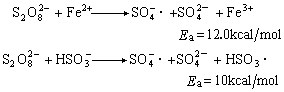
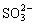 、硫代硫酸鹽
、硫代硫酸鹽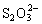 、一縮二亞硫酸鹽
、一縮二亞硫酸鹽 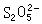 和連二亞硫酸鹽
和連二亞硫酸鹽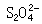 ,可用通式SxO恆表示,它們與過硫酸鹽的氧化還原反應為:
,可用通式SxO恆表示,它們與過硫酸鹽的氧化還原反應為: 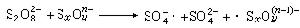
 氧化還原聚合
氧化還原聚合
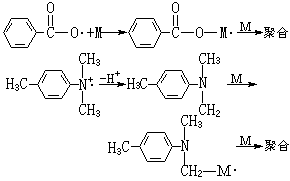
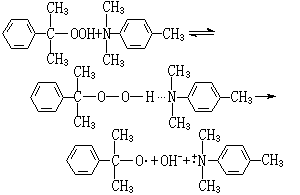
有機過氧化氫物和胺引發體系 是目前用於厭氧膠的引發體系,其典型代表為異丙苯過氧化氫物和DMT體系。它的引發聚合機理與 BPO-DMT體系略有不同。過氧化氫物和胺先形成氫鍵複合物,然後分解成烷氧自由基而引發單體聚合:
其他氧化還原引發體系 包括由非過氧化物組成的氧化還原引發體系,其中有一類含有金屬離子組分,如羥胺和金屬離子Ti3+、Cr2+、V2+、Mo3+的體系,其反應為:
NH2OH+Ti3+─→·NH2+OH-+Ti4+
鈰鹽(主要是硝酸鹽或硫酸鹽)可與許多有機化合物(如醇、醛、酮、胺、硫醇等)組成氧化還原引發體系。鈰鹽與醇的引發反應是先形成複合物,然後分解生成自由基,可引發水溶性單體聚合: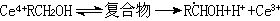
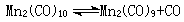
Mn2(CO)9+CCl4─→複合物+CO
複合物─→·CCl3+複合物
此外,還有NaClO3-Na2SO3、KMnO4-草酸、硫脲和KBrO3或KMnO4等的氧化還原引發體系。氧化還原聚合引發速率和轉化率 氧化還原聚合引發速率Ri和引發劑的兩個組分的濃度成正比:
Ri=kd【氧化劑】【還原劑】
式中kd為分解反應速率常數。如果氧化還原分解產生的兩個初級自由基都引發單體聚合,則要乘以2,如果只有一個自由基引發就不必乘以2。聚合速率是由引發速率Ri(最慢的一步)所決定的,因而Ri快則聚合速率Rp也快。雖然提高引發體系的任何一個組分的濃度,都可以提高引發速率,也就是提高聚合速率,但對聚合最終轉化率的影響則不相同。一般,最好是用過量的過氧化物,
 。如果還原劑用量過多,則它會與初級自由基反應,所以過量的還原劑起緩聚或阻聚作用,反而使聚合轉化率下降。過量的Fe2+與初級自由基可發生以下副反應:
。如果還原劑用量過多,則它會與初級自由基反應,所以過量的還原劑起緩聚或阻聚作用,反而使聚合轉化率下降。過量的Fe2+與初級自由基可發生以下副反應: 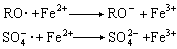
參考書目
G. Odian, Principles of Polymerization,2nd ed., John Wiley & Sons,New York,1981.
馮新德著:《合成高分子化學》,上冊,科學出版社,北京,1981。
