基因發現
1982年Weinberg和Barbacid首先從人膀胱癌細胞系中分離出一種轉化基因,可使NIH 3T3細胞發生惡性轉化,而從正常人組織中提取的DNA則無此種作用。隨後,Santos與Parada發現上述轉化基因並非新型基因,而是Harvery鼠肉瘤病毒ras基因的人類同源基因,命名為H2ras。同年,Krontiris在人肺癌細胞中發現Kirsten鼠肉瘤病毒基因的同系物,稱為K-ras.另一種相似的基因是在人神經母細胞瘤DNA感染NIH3T3細胞時發現的與ras類似的基因,稱為N2ras,此種基因和病毒無關.
基因結構
ras基因在進化中相當保守,廣泛存在於各種真核生物如哺乳類,果蠅,真菌,線蟲及酵母中,提示它有重要的生理功能.哺乳動物的ras基因家族有三個成員,分別是H-ras,K-ras,N-ras,其中K-ras的第四個外顯子有A,B兩種變異體.各種ras基因具有相似的結構,均由四個外顯子組成,分布於全長約30kb的DNA上.它們的編碼產物為相對分子質量2.1萬的蛋白質,故稱為P21蛋白.已證明,H-ras位於人類11號染色體短臂上(11p15.1~p15.3),K-ras位於12號染色體短臂上(12p1.1~pter),N-ras位於1號染色體短臂上(1p22-p32),除了K-ras第四個外顯子有變異外,每個ras基因編碼P21的序列都平均分配在四個外顯子上,而內含子的序列及大小相差很大,因而整個基因也相差很大,如人K-ras有35kb長,而N-ras長為3kb.由於有兩個第四號外顯子,K-ras可以兩種方式剪接,但編碼K-ras-B的mRNA含量高.除K-ras-B含有188個胺基酸外,其他兩種Ras蛋白均含有189個胺基酸.
Ras蛋白
3.1 Ras蛋白的結構
Ras蛋白為膜結合型的GTP/GDP結合蛋白,相對分子質量為2.1萬,定位於細胞膜內側.它由188或189個胺基酸組成,它的第一個結構域為含有85個胺基酸殘基的高度保守序列,接下來含有80個胺基酸殘基的結構域中,Ras蛋白結構輕微不同,除了K2Ras末端25個胺基酸由於不同的外顯子而分為A型和B型外,其餘Ras家族成員最後四個胺基酸均為Cys1862A2A2X2COOH序列.Ras蛋白存在4種異構型:H2Ras,N2Ras,K2Ras4A和K2Ras4B,它們是3種基因的產物,其中K2Ras4A和K2Ras4B是同一基因不同剪接的結果.
3.2 Ras蛋白的功能
Ras(P21)蛋白位於細胞膜內側,它在傳遞細胞生長分化信號方面起重要作用.它屬於三磷酸鳥苷(GTP)結合蛋白(一種細胞信息傳遞的耦聯因子),通過GTP與二磷酸鳥苷(GDP)的相互轉化來調節信息的傳遞.P21與GTP和GDP有很強的親和性,而且有較弱的GTP酶活性.正常情況下P21和GDP結合處於失活狀態,當細胞外的生長分化因子把信號傳導到胞膜內側的P21時,可增強P21與GTP結合活性,使P21和GTP結合成為激活狀態,信號系統開放.因為P21有GTP酶活性,可使GTP水解成GDP,P21和GDP結合後P21失活,信號系統關閉.正常情況下P21的GTP酶活性很弱,當和GTP酶激活蛋白(GAP)結合後其水解速度可提高1萬倍而使P21失活.P21和GDP結合後可以激活鳥苷酸釋放蛋白(GNRP),GNRP使P21釋放GDP結合GTP,因此通過GTP和GDP的相互轉化可以有節制地調節P21對信號系統的開啟和關閉,完成生長分化信號傳入細胞內的過程.
Ras蛋白在合成後,需要經過兩種方式翻譯後修飾,才可定位於細胞膜內側.①通過FTase在Ras蛋白羧基端的CAAX四肽結構中的Cys殘基上加上一個類異戊二烯基團法尼基,隨後AAX殘基從C端上斷裂脫落,法尼基化Cys
羧甲基化,此修飾使RasC端具有疏水性;②N2或H2ras的半胱氨酸的S2醯基化,長鏈的S2醯基取代基使ras具有疏水性.有研究表明,激活ras的表達能增強血管生長因子(例如VEGF/VPF)的表達,提示Ras蛋白在血管生成中發揮作用,抑制Ras蛋白活性能抑制依賴Ras蛋白的腫瘤細胞增殖,也能幹擾血管生成.同時,激活Ras蛋白還能抑制凋亡.Ras蛋白過度表達還能增加藥物和紫外光誘導的凋亡,可能的機制是ras癌基因增強了細胞分解過氧化氫的能力從而抑制凋亡.然而,這個假說還需進一步研究.
基因活化機制
4.1 ras基因激活的方式
作為原癌基因的ras基因被激活以後就變成有致癌活性的癌基因.ras基因激活的方式有3種:基因點突變,基因大量表達,基因插入及轉位.其中ras基因被激活最常見的方式就是點突變,多發生在N端第12,13和61密碼子,其中又以第12密碼子突變最常見,而且多為GGT突變成GTT.不同突變位點對P21的活化機制不同,第12密碼子突變可以減弱P21內在的GTP酶活性,並使細胞凋亡減少,細胞間接觸抑制減弱;第61密碼子突變可削弱GAP對P21的內在GTP酶活性,並可減弱GAP與P21結合的穩定性.
4.2 ras基因突變致癌的機制
ras基因激活構成癌基因,其表達產物Ras蛋白發生構型改變,功能也隨之改變,與GDP的結合能力減弱,和GTP結合後不需外界生長信號的刺激便自身活化.此時Ras蛋白內在的GTP酶活性降低,或影響了GTP的活性,使Ras蛋白和GTP解離減少,失去了GTP與GDP的有節制的調節,活化狀態的Ras蛋白持續地激活PLC產生第二信使,造成細胞不可控制地增殖,惡變.同時細胞凋亡減少,細胞間接觸抑制增強也加速了這一過程.
信號轉導途徑
Ras2MAPK信號轉導途徑
5.1 Ras上游通路
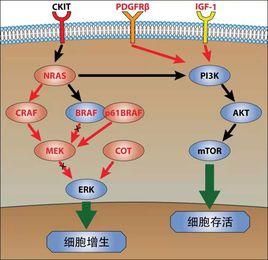
Ras能被複雜的網路激活.首先,被磷酸化激活的受體如PDGFR,EGFR直接結合生長因子受體結合蛋白(Grb2),這些受體也可以間接結合併磷酸化含有src同源區2(SH2)結構域的蛋白質(例如Shc,Syp)後,再激活Grb2.第二,Grb2的src同源區3(SH3)結構域與靶蛋白如mSos1,mSos2,C3G及發動蛋白(dynamin)結合.C3G與連線蛋白Crk的SH3結構域結合後耦聯酪氨酸磷酸化而激活Ras.Crk也能結合mSos1激活Ras.Grb2與激活的受體結合促進鳥苷酸交換因子(Sos)蛋白定位在與Ras相鄰的細胞膜上.這樣,Sos與Ras形成複合體,GTP取代GDP與Ras結合後,Ras被激活,當GTP水解成GDP後Ras失活.Ras具有內在GTPase活性,它的活性可被RasGAPs調節,因而RasGAPs扮演Ras活性調節劑的角色.另外,Ras失活也受到高度調節。有三種蛋白質能水解GTP使Ras失活,它們分別是P120GAP,neurofibromin和GAP1m,統稱為RasGAPs.
5.2 Ras下游通路
5.2.1 Ras/Raf通路
至今,Ras/Raf通路是最明確的信號轉導通路.當GTP取代GDP與Ras結合,Ras被激活後,再激活絲蘇氨酸激酶級聯放大效應,招集細胞漿內Raf1絲蘇氨酸激酶至細胞膜上,Raf激酶磷酸化MAPK激(MAPKK),MAPKK激活MAPK.MAPK被激活後,轉至細胞核內,直接激活轉錄因子.另外,MAPK刺激Fos,Jun轉錄因子形成轉錄因子AP1,該因子與myc基因旁的特異的DNA序列結合,從而啟動轉錄.myc基因產物也是轉錄因子,它能激活其他基因.最終,這些信號集中起來誘導D型Cyclin的表達和活性.D型Cyclin與Cyclin依賴性激酶(如CDK4和CDK6)形成複合體,該複合體的形成促使細胞從G1期進入S期.因此,Ras/Raf通路在受體信號和G1期進展之間起著關鍵作用.然而,Ras/Raf通路不是調控G1期進展的惟一通路.Ras與Raf單獨結合不能促進Raf激酶活性,同時,Raf能被不依賴Ras的機制所激活(例如能被Src酪氨酸激酶和PKC所激活),MAPK也能被不依賴Ras機制(如通過調節整合素的活性)所激活.表明級聯反應每一個信號蛋白質都能被多個上游蛋白質所激活,而它們也可能有另外的靶蛋白.另一個重要的Ras通路效應物是Cyc2lin依賴性激酶抑制劑P21Waf1/cip1,它被Ras所誘導,抑制Cdk2CyclinE和Cdk2CyclinA複合體的活性,從而阻斷DNA的合成.
5.2.2 Rho/Rac通路
Rho家族蛋白質是小G蛋白的Ras超家族成員,其胺基酸序列大約有30%與Ras蛋白相同,三個主要的Rho蛋白是Cdc42,Rho,Rac.Cdc42刺激Rac,Rac接下來刺激Rho.然而,這個直線模型對於精確的信號轉導通路來說過於簡單,因為有證據顯示交叉聯繫存在,例如Cdc42不通過Rac能影響Rho的活性.下游靶點Rho激酶α的激活,導致肌動蛋白的重新構建和P21激活的絲蘇胺基酸激酶參與應力纖維的分解.最後Rac和Cdc42利用MAPK傳遞信號至核內,Rho通過刺激Src和fos啟動子達到轉錄調節的作用.另外,Rac和Cdc42激活JunN端激酶,該酶結合Jun,EIk1和ATF2等轉錄因子,這就是Rho在細胞癌變過程中起重要作用的可能機制.另一個重要Rho下游靶點是P21Waf1/cip1.Rho抑制P21Waf1/cip1誘導,有利於Ras驅動細胞進入S期,P21Waf1/cip1陰性細胞不需要Rho進行Ras激活的DNA合成,降低了通過誘導P21Waf1/cip1在Ras轉化過程中的重要性.
5.3 Ras2MAPK信號途徑與腫瘤的關係
腫瘤發生與調控細胞增殖的信號發生異常有關.一些腫瘤病人生長因子或其受體的表達或功能出現異常,如卵巢癌病人血清中EGF和胰島素樣生長因子含量升高;EGF增高影響細胞間連線,促進細胞轉移和浸潤.臨床資料表明,酪氨酸蛋白激酶受體過表達與腫瘤相關,ErbB22在乳癌病人中30%過表達;起源於上皮的肺癌,乳癌等EGFR過表達,並與高轉移率,低生存率以及差的預後相關,通過降低EGFR表達可抑制EGFR過表達的卵巢癌細胞的增殖.腫瘤細胞ras基因突變率大約為25%,而胰腺癌和結腸癌分別達到85%和40%.ras癌基因主要以點突變和基因擴增方式存在,突變位點在第11,12,13,18,59,61密碼子,是Ras蛋白和GAP的作用位點,由於突變,抑制了Ras內在的GTP酶活性,突變的Ras鎖定在持續激活的Ras2GTP狀態,引起細胞的惡性轉化.raf癌基因與人類腫瘤關係密切,很少突變,但Raf持續活化,可導致細胞惡性轉化;在小細胞肺癌病人的組織標本中,Raf在mRNA和蛋白水平均過表達,活性增高.在腫瘤治療的研究中,可從以下幾方面阻斷Ras2MAPK信號轉導途徑:①酪氨酸蛋白激酶抑制劑,如Radici2col抑制V2Ha2ras轉化的NIH3T3細胞的MAPK活性,使細胞表型逆轉;新研究的酪氨酸蛋白激酶抑制劑能雙重作用ErbB22和EGFR,廣泛抑制ErbB22或(和)EGFR過表達的腫瘤生長.②抑制Ras法尼基化:法尼基轉移酶抑制劑(FTIs)是分子水平抗癌藥,抑制ras翻譯後修飾,已有多種FTIs用於動物模型和臨床前期實驗,有明顯的抗腫瘤作用,如SCH66336對表達高水平H2Ras2GTP和ras是否突變的腫瘤都有生長抑制作用,已進入臨床試驗.③反義核苷酸技術:C2H2ras反義RNA質粒降低人胃癌BGC2823細胞的H2ras表達並抑制細胞生長和部分惡性表型逆轉;Raf21反義DNA抑制人白血病細胞的增殖.④其他:針對受體酪氨酸激酶與底物作用的SH2區或SH3區設計多肽,在體外實驗抑制酶和底物結合.
臨床套用
6.1 診斷
ras癌基因和P21在許多癌前病變中都有表達.Ochi等發現1例胰液中K2ras突變陽性而細胞學及影像學檢查均陰性的病例,隨診18個月後才發現惡性細胞及影像學的變化.提示ras基因突變早於病理檢出及臨床表現的出現.提示可用檢測ras癌基因或P21的方法對癌變傾向提供較早信息.Kimura等檢測切除的胰腺標本中K2ras的突變率,在胰導管癌,胰黏液細胞癌和慢性胰腺炎中分別是81%,53%和7%,相應胰液中的突變率分別為72%,53%和0,所以檢測胰液中突變的K2ras基因即可為臨床診斷提供有力的幫助.Futakawa等檢測52例胰腺癌病人胰液中突變的K2ras基因和癌胚抗原水平,結果顯示這兩項指標聯合檢測在胰腺癌診斷中的準確度是90%,因此可用聯合檢測的方法及早而準確地診斷腫瘤.
6.2 病情評估及預後判斷
Shirakawa等通過檢測P21,P53,Ki67和細胞角蛋白10發現食管鱗癌的分化程度取決於發育不良的程度,而P21在這個演化過程中起關鍵作用.Rak等發現突變的ras基因可強效刺激血管內皮細胞生長因子的表達.Thebo等對有K2ras12或13密碼子突變的DukesB2期結直腸癌進行分析顯示,80%的原發灶和局域淋巴結髮生相同位點的ras基因突變,說明ras基因突變對腫瘤淋巴結轉移是高風險因素.有文獻報導,唾液腺癌中H2ras基因突變率與臨床病理指標呈高度正相關,可通過檢測基因突變來推測腫瘤所處的階段和分化程度.可見檢測突變的ras基因可為臨床病情的評估提供有力的依據.
Harada等研究表明,P21(-)者5年生存率為64.1%,(+)者為38.0%,⑹者為11.5%,P21是決定生存率的重要而獨立的指標.但許多文獻報導ras基因突變和臨床病理指標及預後沒有明顯的關係.聯合檢測非小細胞肺癌組織中K2ras,p53和cerbB2基因的異常表達,比單項檢測可明顯地提高對預後的評估,因此,可用聯合檢測對某種腫瘤較敏感的幾個癌基因的方法來對預後進行評估.
6.3 治療
研究表明,體外給予結腸癌細胞(HCT116/P21+/+)P21反義寡脫氧核苷酸,可提高癌細胞對放療的敏感性;用末端含CAAX鹼基的製劑作用於人類ras癌基因轉染的動物細胞,可抑制癌細胞的生長;用核糖酶(K2rasR2)拮抗突變的K2ras12細胞系,可使細胞生長停止,凋亡增加,VEGF基因表達受抑.可見用分子生物學的方法治療腫瘤是有廣闊套用前景的.
總之,雖然對ras基因,Ras蛋白及Ras信號轉導通路的研究已達一定的深度,ras基因已在臨床有一些套用,但仍有許多問題需解決,如ras基因突變發生在腫瘤形成的那些階段,Ras信號轉導通路與其他信號轉導通路相互影響,相互交叉,阻斷單一信號轉導通路能否真正起到改變或影響腫瘤發生髮展的作用等.隨著對這些問題的研究,解決,人們將對腫瘤的預防,診斷和治療提供更新更有效的方法.
Ras癌基因參與人類腫瘤的發生髮展,最初是在急性轉化性逆轉錄病毒實驗中從Harvey、Kirsten兩株大鼠肉瘤病毒中克隆出來的轉化基因,自1982年Weinberg等人發現人的膀胱癌細胞中有活化的H-ras基因後,引起了人們對ras癌基因在人類腫瘤發生髮展過程中所起的作用的極大關注。
ras基因家族與人類腫瘤相關的基因有三種——H-ras、K-ras和N-ras,分別定位在11、12和1號染色體上。其中,K-Ras則對人類癌症影響最大,它好像分子開關:當正常時能控制調控細胞生長的路徑;發生異常時,則導致細胞持續生長,並阻止細胞自我毀滅。