疾病分類
| 表1:世界衛生組織(WHO)2000年的分類 |
|---|
| 1. 生殖細胞瘤(Germinoma) |
| 2. 畸胎瘤(Teratoma) |
| a) 未成熟性(Immature teratoma ) |
| b) 成熟性(Mature teratoma) |
| c) 畸胎瘤惡性轉化(Teratoma with malignant transformation) |
| 3. 胚胎癌(Embryonal Carcinoma) |
| 4. 內胚竇瘤(Endodermal sinus tumors) ,又稱卵黃囊瘤(yolk sac tumor) |
| 5. 絨毛膜上皮癌(Choriocarcinoma) |
| 6. 混合性生殖細胞腫瘤(Mixed Germ Cell Tumors) |
顱內生殖細胞腫瘤在顱內腫瘤中發病率較低,東南亞國家發病率較高,西方國家CGTs在顱內腫瘤中占0.3~0.5%,而在日本占2.1~9.4%,天壇醫院統計1996~2002年資料,CGTs則占同期顱內腫瘤的1.9%,顱內生殖細胞腫瘤的發生部位絕大多數在中線附近,如鞍上和松果體區,基底節及丘腦,少數可發生在側腦室、第三腦室、大腦半球、小腦半球或腦幹等。
顱內生殖細胞腫瘤極具性別特點,即男性發病明顯高於女性。松果體區生殖細胞瘤中男性多見,基底節及丘腦生殖細胞瘤基本皆為男性,而鞍上生殖細胞瘤女性略占優勢。
發病原因
生殖細胞腫瘤的病因和發病機理尚不明確。多數學者認為所有生殖性腫瘤均起源於胚生殖細胞,根據Teilum(1965)的理論,生殖細胞瘤起源於胚生殖細胞,而生殖細胞又可演變為全潛能細胞及胚胎癌幹細胞,進一步形成胚胎癌,絨癌,卵黃囊瘤和畸胎瘤。
除成熟性畸胎瘤屬於良性外,其他生殖細胞腫瘤皆屬於惡性,瘤細胞可脫落在CSF中,在腦室內和蛛網膜下腔發生種植和播散,極少數可沿血液轉移到中樞神經系統之外如肺、淋巴結、骨骼等;也可通過V-P分流由CSF發生腹腔內種植,也由進入CSF的瘤細胞種植到脊髓,MR上可見脊髓多發占位。
臨床表現
依據腫瘤部位、性質、大小等因素決定其症狀和體徵。除了腫瘤占位效應、壓迫鄰近的腦組織外,還可梗阻腦脊液循環,引起顱內壓增高和腦室擴大;腫瘤在松果體區多引起顱壓增高和眼球運動障礙;鞍區常有多飲多尿和發育遲滯;底節丘腦則多為輕偏癱等。
松果體區生殖細胞腫瘤腫瘤位於松果體區,早期壓迫導水管可有顱壓增高,繼之壓迫動眼神經核可導致眼球垂直運動障礙,晚期壓迫四疊體下丘造成聽力減退、壓迫小腦上蚓部或小腦上腳造成走路不穩等,一般病程較短,自20天~1.5年,平均為4個月。
1.顱內壓增高
表現為頭痛、嘔吐及視乳頭水腫,其他尚有視力減退(視神經繼發性萎縮)和雙側外展神經麻痹等。
2.四疊體受壓綜合徵(又稱Parinaud綜合徵)
腫物壓迫中腦背蓋部的動眼神經核,表現為眼球垂直方向運動障礙,瞳孔散大或不等大。
3 .內分泌症狀
① 性早熟:多數性早熟為松果體區畸胎瘤,極少數表現為性徵發育停滯或不發育
② 內分泌紊亂:也可有尿崩症:多見於松果體區生殖細胞瘤患者,可能松果體區生殖細胞瘤脫落的瘤細胞種植到漏斗隱窩,而發生垂體柄附近的生殖細胞瘤有關,松果體區生殖細胞瘤在CT及MRI上能顯示三室前部有較小的腫瘤。亦有的患者雖然有多飲多尿,但鞍上未見到明顯的影像學異常,是否與第三腦室前部擴張影響丘腦下部分泌的激素變化有關,也可能是腫瘤細胞浸潤至丘腦下部尚未達到影像學改變的程度
4.其他腦受壓征
① 腫瘤生長較大時可壓迫四疊體下丘或內側膝狀體而出現聽力減退
② 小腦體徵:腫瘤向後下發展可壓迫上蚓部和小腦上腳,出現軀幹性共濟失調及眼球震顫,表現為走路不穩。
③ 少數可有癲癇發作,單側或雙側錐體束征,甚至可昏迷,為顱內壓增高、顱內腫瘤播
散或中腦受壓所致。
通常鞍上生殖細胞瘤表現有“三聯征”:即尿崩症、視力減退和垂體功能低下。
1.尿崩症
患者有多飲多尿。腫瘤起源於神經垂體,早期浸潤和破壞垂體後葉引起尿崩症,90%以上的病例以尿崩症做為首發症狀,常常一直被當做“原發性尿崩症”來對症治療,直到視力視野損害才被發現為鞍上生殖細胞瘤。多數有尿崩症者皆有消瘦,面色蒼白或萎黃,皮膚乾燥,發育矮小。 專家建議對多飲多尿患兒不能輕易做出“中樞性尿崩症”的診斷,定期複查是很有必要的。需要指出的是尿崩症患兒在治療後,尿崩症狀改善或緩解的患兒不到半數,多數患兒仍需口服或注射抗利尿的藥物來維持正常生活。
2.視力視野障礙
腫瘤浸潤和壓迫視神經及視交叉可引起視力視野障礙,主要表現為視力減退,甚至失明,視野多為雙顳側偏盲,個別有同向性偏盲或視野縮小。
3.垂體前葉功能減退
腫瘤浸潤和壓迫垂體前葉,造成其內分泌功能減退,兒童表現為發育停滯,成人可性慾減退、陽痿或閉經等。專家建議,對於矮小及性徵不發育的兒童,除到內分泌科就診外,神經外科就診,行頭部MRI掃描亦很有必要。
1.進行性輕偏癱
基底節區CGTs最常見的症狀。文獻報告基底節生殖細胞瘤幾乎皆為男孩,女孩偶見。最初發生在上肢或下肢,進展緩慢,其肢體肌力下降的程度並不嚴重。僅表現為一側肢體動作笨拙,有時手指有不自主扭曲,下肢活動的準確性差。在日常生活中通常表現為偶有的騎腳踏車摔倒,握筆或筷子不穩等
2.基底節及丘腦生殖細胞瘤
患者除有輕偏癱外,少數患者尚有智力減退,少數患者尚有性早熟。極少數表現為性徵發育停滯或不發育。個別病人還出現小腦神經機能聯繫不能,強迫症,局限性癲癇等症狀。腫瘤生長較大可梗阻室間孔(Foramen of Monro),造成顱壓增高,雙側腦室擴大,表現為頭痛、嘔吐。
診斷鑑別
輔助檢查一、影像學檢查
1.神經影像學檢查(Radiological manifestations)
常用的神經影像學檢查包括電子計算機斷層掃描(Computed Tomography CT)和磁共振成像(Magnetic Resonance Imaging MRI),PET-CT。MRI檢查對於顯示小的松果體區、鞍區腫瘤病灶(小於1cm),脊髓或腦室內等其他部位的小病灶是CT所無法比擬的。對生殖細胞腫瘤的顱內、脊髓轉移灶更有獨到之處,對腫瘤的分期、手術入路的選擇及對放療範圍的確定等都有重要的價值。但CT對有鈣化的顱內生殖細胞腫瘤的觀察明顯優於MRI。
顱內生殖細胞腫瘤在神經影像學上很有特點,但做出診斷前一定和臨床表現及腫瘤標記物的測定相結合才能使診斷更為準確。對可疑病例加強隨診觀察。
2.其它影像學檢查
部分惡性顱內生殖細胞腫瘤可通過血源性向顱外播散,常見肺和骨。而顱內生殖細胞腫瘤的主要發病人群為兒童及青少年,過多的X線檢查可能影響生長發育。是否在治療前常規行胸部X線/CT,全身骨掃描,PET等需要醫生根據具體病例和家屬的要求決定
專家建議,疑顱內生殖細胞腫瘤者應儘可能行全腦全脊髓MRI掃描,既有益於診斷又為更好地治療提供依據。
二、腦脊液細胞學檢查(Cytologic exanmination of CSF)
此項檢查基於生殖細胞瘤或NG-MGCTs的瘤細胞常常脫落於CSF中,此時取CSF送病理科做細胞學檢查,有些可查到瘤細胞,結合臨床可診斷為顱內顱內生殖細胞腫瘤。專家建議,此項檢查的前提是患者顱內壓不高,否則有發生腦疝的風險。
三、腫瘤標誌物(Tumor makers)
腫瘤標誌物為腫瘤產生的生物學物質,它的存在可指示出某種腫瘤的存在,如生殖細胞瘤產生不同種類的胚胎蛋白。因腫瘤細胞產生的標記產物直接進入腦脊液中,故腦脊液中腫瘤標記物的濃度常為血液的8-10倍,有些患者可高達30~40倍。良性畸胎瘤的腫瘤標記物為陰性。因多數生殖細胞瘤都伴有顱內壓增高,較難獲取CSF
腫瘤標誌物在顱內生殖細胞腫瘤中可檢測到很多種,臨床上測定較多的為 甲胎蛋白(alpha-fetoprotin AFP), β-絨毛膜促性腺激素(human chorionic gonadotropin beta β-HCG), 胎盤鹼性磷酸酶(placental alkaline phosphatase PLAP) 和 癌胚抗原(Carcinoembryonic Antigen CEA) 等,這些標誌物陽性說明存在顱內生殖細胞腫瘤的可能性,經過治療的生殖細胞腫瘤可以通過這些腫瘤標記物的變化(治療有效時明顯下降,部分可降至正常水平。而再度升高則提示腫瘤復發)評價治療效果,治療後的腫瘤可以通過腫瘤標記物檢測判斷是否有復發。
如前述,如腫瘤標誌物陰性,不能完全排除顱內生殖細胞腫瘤,但如陽性對顱內生殖細胞腫瘤診斷有很大參考價值。如HCG和AFP皆高或僅有AFP高應考慮為NG-MGCTs,HCG輕-中度升高表明可能為含有合體滋養層巨細胞(syncytiotrophoblastic giant cells, STGC)的顱內生殖細胞腫瘤,如僅有一部分生殖細胞瘤HCG呈輕-中度升高但AFP陰性。而HCG若>1000mIU/mL,則考慮為絨癌或含有絨癌成份的混合性生殖細胞腫瘤。
四、腫瘤活檢
立體定向活檢為確診生殖細胞瘤的方法之一,可做出病理診斷,為下一步的治療提供可靠的依據,但這畢竟是一項侵襲性檢查,且很多情況下活檢因風險巨大而不可行,如鞍區垂體柄上小體積的腫瘤,立體定向活檢幾乎不可能。只有較大的腫瘤且部位較好才有可能活檢,因此結合病情、影像學及腫瘤標記物,對懷疑為生殖細胞瘤的患者行“診斷性放療”尚不失為一種簡便、經濟和比較準確的方法。專家提醒:因活檢取得的標本量很少,活檢得到的病理診斷易誤診
五、診斷性放療
實驗性放療(Radiation tests)又稱診斷性放療(Diagnostic radiotherapy)是在根據臨床表現、影像學、腫瘤標記物等高度懷疑生殖細胞瘤時,在沒有病理診斷的情況下採用小劑量的放療,根據腫
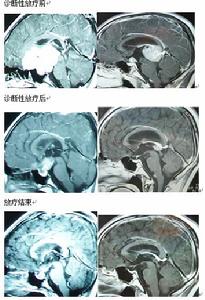
生殖細胞瘤的高發地日本於1983年首先提出實驗性放療的概念,並運用至今。專家提醒:要確認腫瘤或占位的病理性質只有手術切除或者活檢兩種方法.試驗性放療是間接判斷生殖細胞腫瘤(GCTs)/占位具體性質的一種簡便.實用,較安全的方法,多數情況下可區分germinoma和NG-GCTs或其它性質占位,但通過此方法得出的初步診斷,是個人的主觀判斷,只有經過長期實踐,積累了豐富臨床經驗的醫生才能勝任,才能最大限度的減少誤診誤治的可能.見圖。
六、試驗性化療
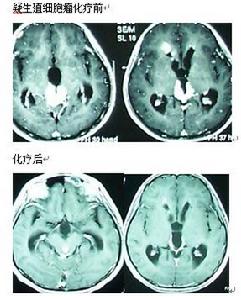
以順鉑(PDD)為基礎的化療對顱內生殖細胞瘤有極好的效果。國外方案有PVB(PDD+VBR+Ble),PE(PDD+Vp-16),CE(Carboplatin+Vp-16)。天壇醫院從1993年開始生殖細胞瘤化療,藥物為順鉑、甲氨喋呤(MTX)、長春新鹼(VCR)和平陽黴素(Pen),可稱為VMPP方案,此方案運用至今,已治療病例數超過1000人,效果良好。
臨床疑NG-MGCTs且AFP陽性患者可採用PEB,VIP等方案,化療目的:判斷腫瘤對化療的敏感性,決定下一步治療方案。見圖。松果體區生殖細胞瘤
一、疾病診斷
男性兒童有頭痛、嘔吐和視乳頭水腫,眼球上視困難應考慮松果體區占位性病變,此時應行CT/ MRI檢查,如平掃示松果體區有等或稍高密度實性腫物,有中心或周邊彈丸狀鈣化或散在細小鈣化斑
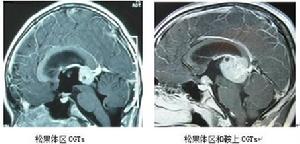
松果體區畸胎瘤年齡較生殖細胞瘤偏低,幾乎皆為男性。CT和MRI為多房囊性、結節狀或分葉狀的低密度多囊性病變。但成熟或未成熟性畸胎瘤術前準確判定其性質是很困難的。有時病理診斷也可能出現誤診的情況。見圖1
二、鑑別診斷
1.松果體囊腫
為良性病變,國外屍檢存在率高達40%。多數較小,只有在MRI檢查時偶然發現。多數在MRI上松果體區由小而圓的囊腫,注藥後輕度環形強化,有時囊腫較大可稍壓迫四疊體上丘,多無臨床症狀,也不引起腦積水,絕大多數不需手術治療。
2.松果體細胞瘤,松果體母細胞瘤,中等分化的松果體實質瘤,松果體區乳頭狀腫瘤
神經影像上不易與松果體區生殖細胞腫瘤區別,但以上腫瘤無性別傾向,平均年齡較顱內生殖細胞腫瘤者大(多在18歲以上的成人)。
3.神經膠質瘤
多數為星形細胞瘤,極少數為室管膜瘤、膠質母細胞瘤或低分化膠質瘤,起源於四疊體或第三腦室後壁。星形細胞瘤在兒童通常可很小,但早期引起梗阻性腦積水,MRI見腫物比較局限並與四疊體熔為一體,壓迫導水管,使其狹窄或閉鎖,注藥後多不強化或輕度強化稱為“頂蓋星形細胞瘤”,本病極有特點,即腫瘤很小而幕上腦積水卻較嚴重,這種病人病史多很長,症狀不嚴重。有時可偶然(如外傷後)發現。
4.腦膜瘤
松果體區腦膜瘤少見,多為成人(常發生於40-60歲),常有慢性顱內壓增高,腫瘤常起源於小腦幕切跡游離緣,可在正中,也可偏向一側。腫瘤常為圓形或橢圓形,CT為均勻稍高密度,注藥後可明顯均勻強化。腫瘤血供豐富,DSA可見腫瘤有染色。MRI在T1WI為均勻等或稍高信號,注藥後可明顯均勻強化,並可顯示在小腦幕上有腦膜尾征(冠狀掃描顯示更為清楚)。
5.脂肪瘤
可發生在松果體區,為先天性病變,實際上為胎兒生長發育過程中脂肪組織的異位和迷離的結果,多數可很小,影像學隨診腫物體積可終生不變,也不引起症狀,更無需手術。CT可見松果體區極低密度腫物,MRI表現為T1WI高信號腫物,邊界清楚,無強化。
6.上皮樣囊腫或皮樣囊腫
可發生在松果體區,可較大,CT為低密度,CT值低於CSF;MRI在T1像為低信號,T2像可變化較大,從低信號到不均勻信號皆可出現。上皮樣囊腫邊界可不規則,部分邊界可呈蟲蝕狀或鋸齒狀,可能因腫瘤質軟,故腦積水多不嚴重。皮樣囊腫CT為不均勻低密度,邊界清楚;MRI可表現為混雜信號影,有的患者在腦室內可見液態油脂,有流動性。
7.蛛網膜囊腫
有時囊腫可較大,囊內密度或信號在CT及MRI為相似於CSF,囊壁薄,注藥後可輕度或無強化,囊腫體積較大時可導致幕上腦積水。鞍上生殖細胞瘤
一、疾病診斷
兒童或青少年首發症狀為尿崩症,女性多於男性,常伴有消瘦和發育矮小等發育遲滯症狀。症狀持續數月或數年後可出現視力下降。CT示鞍上等或低密度影,無鈣化。MRI在T1像可見
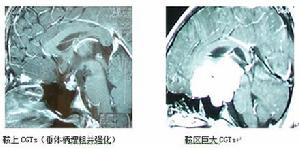
鞍上畸胎瘤絕大多數為未成熟性或惡性。CT和MRI可見鞍區混雜信號或多囊性占位,注藥後可有明顯強化。首發症狀也可多為多飲多尿,但發生率低於生殖細胞瘤,前者大約為50-70%,而生殖細胞瘤則為95%~100%。見圖。
二、鑑別診斷
1.顱咽管瘤(Craniopharyngioma)
顱咽管瘤為先天性胚胎殘餘組織發生得腫瘤,多見於兒童,多有垂體功能低下,發育矮小和性徵不發育。有時也呈向心性肥胖,生殖器呈幼稚型。症狀中不像鞍上生殖細胞腫瘤以尿崩為首發症狀,顱咽管瘤首發症狀為視力視野改變和顱壓增高症,尿崩症發生率低(30%左右)且常在腫瘤的晚期才出現。
CT以鈣化為特點(鈣化率大於95%),為周邊蛋殼樣,也可在瘤內呈斑塊狀散在鈣化,愈接近鞍部鈣化愈明顯,常阻塞室間孔使側腦室對稱性擴張。MRI在T1WI顯示為高低不同信號,實質成分常為等或低信號,囊性成分可為等或高信號,儘管囊性成分和實性成分在T2WI皆為高信號,但囊性區的膽固醇結晶成分比實性成分信號還高。
2.下丘腦和視交叉膠質瘤(Hypothalamic or Optic chiasmal glioma)
在兒童是鞍區第二位常見的腫瘤,多數為毛細胞型星形細胞瘤。可發源於丘腦下部,但多數源於視交叉,如腫瘤巨大時則很難判斷具體的原發部位。下丘腦星形細胞瘤多為實性,CT為等或稍低密度,無鈣化。MRI在 T1WI為等或稍低信號,T2WI為高信號,質地均勻或不均勻,注藥後可輕度強化到明顯強化,影像學因兩者皆很少有鈣化而不易鑑別時則主要憑臨床症狀:即生殖細胞瘤在鞍上多以多飲多尿起病,星形細胞很少有尿崩症的表現。
3.垂體腺瘤(pituitary Adenoma)
多見於成人,發生於垂體前葉,無功能腺瘤患者可有內分泌功能低下,出現閉經,性慾下降等表現;泌乳素腺瘤表現為閉經泌乳綜合症;生長激素腺瘤在兒童表現為巨人症,成人為肢端肥大症;ACTH腺瘤表現為柯興氏(Cushing’s)綜合症,表現為向心性肥胖,滿月臉,水牛背,高血壓及皮膚紫紋等。在冠狀掃描可呈葫蘆狀,蝶鞍可有明顯擴大,可有瘤內出血或囊變,在CT及MRI上顯示密度和信號不均勻,可由鞍內向鞍上發展,注藥後強化明顯。
4.皮樣囊腫和上皮樣囊腫(Dermoid or Epidermoid)
鞍上皮樣囊腫或上皮樣囊腫少見,CT為低密度,T1WI為低信號,T2WI為低信號到不均勻高信號,注藥後無強化。
5.鞍結節腦膜瘤(Tuberculum Sellae Meningiomas)
多見於中年女性,無內分泌功能障礙,常有視力視野改變。CT表現為鞍結節區高密度影,注藥有明顯強化。MRI在T1WI表現為稍高信號,邊界清楚,可有腦膜尾症,有時延伸至鞍內,注藥有明顯強化。
6.垂體柄組織細胞增多症(Histiocytosis of the Pituitary Stalk)
垂體柄組織細胞增多症者累及垂體柄和下丘腦時可有尿崩症,CT及MRI可見鞍區腫物,表現很像下丘腦-神經垂體的生殖細胞瘤,但本病多有骨溶解病灶或肺部病變,確診需做活檢。
7.淋巴性漏斗神經垂體炎(Lymphocytic infundibulo- Neurohypophysitis)
又名淋巴細胞性垂體炎(Lymphocytic Hypophysitis)。本病可引起垂體增大,出現頭痛,有尿崩,多發生在成人。MRI可見垂體柄粗大及垂體後葉增大,正常垂體後葉在T1像上的“高信號”消失。術前與生殖細胞瘤很難鑑別
8.下丘腦錯構瘤(Hypothalamic Hamartoma)
發病多在嬰幼兒期,表現為痴笑樣癲癇(Gelastic seizures)和性早熟(precocious puberty)。在乳頭體或灰結節處有等密度或等信號腫物,可突入三腦室底部或向下突入腳間池,有些可伴有顱內先天畸形。無論CT或MRI,在注藥後無任何強化腫物不具有生長性,自出生後至成人如重複MRI或CT檢查可顯示腫物無增大基底節生殖細胞瘤
一、疾病診斷
基底節生殖細胞瘤幾乎皆累及丘腦,多數學者稱之為基底節和丘腦生殖細胞瘤,約占所有顱內生殖細胞瘤的5-10%,居第三位。絕大多數為男性患兒,表現為對側肢體肌力下降,少數可有不自主運動,病史較長。基底節生殖細胞瘤有其獨特的CT表現,腫瘤多為不均勻的稍高密度影,有時呈多囊性,附近腦室受壓相對不嚴重,局部皮層有萎縮,附近腦室額角輕度擴張,Nagata認為引起半球萎縮的原因為Wallerian變性,即腫瘤浸潤和毀壞了腦的白質,尤其是內囊的神經纖是發生皮層萎縮的原因
應當指出一側肢體肌力下降的患兒在行MRI檢查時可能為正常(較長時間後才出現影像學改變)或在基底節有輕微的異常信號。局部腦室(主要為側腦室額角)不僅沒有受壓,反而向同側輕度擴張,此時常常排除了膠質瘤的可能性。MRI在T1像可見信號不均或多房性病變,周圍腦組織多數無水腫,占位效應不明顯(病變體積與腦室受壓移位程度不呈比例),注藥後可有不均勻強化,有些病例在1-2年後可見同側的側裂池增寬,臨近皮層可有輕度萎縮,底節的病灶可稍有增大,這種情況下應當高度懷疑基底節生殖細胞瘤。有文獻報導兒童基底節腫瘤中有50%為生殖細胞瘤。
二、鑑別診斷
此部位多為星形細胞瘤,少數可為膠質母細胞瘤,成年人多見。CT平掃為低密度或等密度,約1/4有囊變,惡性程度越高則信號越混雜,病史較短,腫瘤很少有鈣化,瘤周常有水腫,腫瘤主要位於丘腦。
疾病治療
顱內生殖細胞腫瘤治療方法的選擇依賴於腫瘤的部位,大小和病理性質等諸多因素,各種顱內生殖細胞腫瘤的預後差異很大,每個患者的具體情況也不同,對各類顱內生殖細胞腫瘤制定統一的治療方式是不現實的,但多數強調放療、化療和手術的綜合治療。原則上應對經組織學檢查確診的生殖細胞瘤者先採用化療後補充放療,單獨化療只能治癒部分生殖細胞瘤,但半數病人會復發,單純化療而不加用放療是不可取的。
生殖細胞瘤主要治療手段為中等劑量的放療和以鉑劑為基礎的化療聯合,手術和活檢的目的是取得準確的病理,畸胎瘤主要為手術切除,而其他NG-GCTs則必須全面評估手術切除,術前和或術後化放療的利弊,採取個體化的綜合治療。先化療再手術,術後再化療和放療的“三明治”式治療方法臨床常常被採用。
放射治療是給一定的腫瘤體積準確、均勻的劑量,而周圍正常組織劑量很小的治療方法,這樣既保證了患者的生存又保證了患者的基本生存質量。普通放射治療,是指利用X線通過人體體表進行的常規分割的外照射。
1.照射劑量
生殖細胞瘤是少數可通過根治性放療治癒的腫瘤之一。生殖細胞瘤的放射致死劑量小於正常腦組織5000 cGy的耐受量,因此,傳統的治療模式——單獨放療也可使生殖細胞瘤患者中的多數得到治癒,但其晚期併發症特別對兒童的智力、生長發育的嚴重影響越來越受到放療科醫師、患兒家長高度關注。如何降低照射劑量有效減少晚期併發症成為生殖細胞瘤中的一個十分突出的問題。生殖細胞瘤常用的放療劑量為35-40Gy,而對於NG-MGCTs,常用的放療劑量為50-60 Gy
2.照射範圍
生殖細胞腫瘤的瘤細胞可脫落在CSF中,在腦室內和蛛網膜下腔發生種植和播散。對於何種患者適用於何種照射範圍並沒有客觀標準,選擇是困難的,臨床醫師都是根據對腫瘤的認識和已往的治療經驗來抉擇。
一般有以下幾種照射範圍:局部小野;腦室系統;全腦;全腦全脊髓。後者因其照射範圍大,給治療中得患者帶來較大的胃腸反應和骨髓抑制,尤其對年幼患者今後的生長發育影響嚴重而爭議巨大
Hoffman(1991)認為兒童顱內生殖細胞瘤無播散者,局部放療即可達到良好療效(其5年生存率為85.1%),對3歲以下的兒童生殖細胞瘤應先化療,直到能耐受放療時才加以實施。Tada(1998)指出如CSF中無腫瘤細胞者局部照射已足夠。Huh(1996)認為脊髓軸20Gy可使兒童椎體生長停滯,對青年女性脊髓軸的放療可影響受精卵的著床。JenKin(1990)和Wolden(1995)認為腦脊髓預防性放療已不再必要;Linstadt(1988)和Dearnaley(1990)也認為只有播散性生殖細胞瘤才用顱脊放療。但Brada報告脊髓軸照射者脊髓轉移發生率為5%,而未照射者脊髓轉移發生率為13%。
對於僅限於局部的單發病灶,大部分的作者並不推薦全腦全脊髓照射。Brada和Raja (1993)回顧了以往的文章,發現僅行全腦照射的143例患者中有18例發生脊髓轉移,占13%;而全腦全脊髓放療的39例患者中有3例(5%)發生了脊髓種植轉移。他們的研究表明:對於單發的生殖細胞瘤,脊髓種植轉移率很低,不宜對所有的患者均行全腦全脊髓照射,而且即使行傳統的全脊髓預防照射,也可能發生種植轉移。Daphne (2002)等回顧性的研究了加州大學舊金山和斯坦福兩家醫療中心1968-2001年93例生殖細胞腫瘤的治療,結果表明對局灶性的生殖細胞瘤不需常規行CSI。
經過多因素分析,Haas-Kogan等(2003)認為局部單發的生殖細胞瘤,放療範圍應包括腦室和腫瘤局部,劑量可為45-50Gy,全腦全脊髓放療則不宜採用。Idinstadt(1997)等指出生殖細胞瘤的脊髓轉移危險率極低,常規的預防性脊髓放療是不恰當的,但建議對術中腫瘤有可能播散的患者、有CSF陽性腫瘤細胞者或室管膜下或軟腦膜有已知轉移灶的患者才採用預防性脊髓放療的方法。
我們認為以下幾種情況可作為CSI的適應症:
① MR或CT已證實腫瘤已腦室和或脊髓播散種植;
② 鞍上和松果體區均有腫瘤,患兒年齡較大
③ CSF檢查發現腫瘤細胞。
除此以外可能發生全腦全脊髓種植播散的高危因素為①HCG增高;②手術或
活檢;③鞍區腫瘤較大,突入腦室;④腫瘤位於三室後部。
總之,對於CSI的選擇要區別對待,有CSI適應症的,應採取積極的治療方式:有高危因素的患者,採用個體化方案因人而異,尤其對幼小女童應慎重而行。
3.放療反應
① 消化系統症狀:厭食、噁心、嘔吐、腹瀉為常見症狀。特別是鞍區腫瘤常常壓迫下視丘導致垂體軸功能紊亂,如T3、T4、Cortiso1低,往往加重了患兒的消化道症狀,補充足量的激素特別是糖皮質激素尤為重要。全腦全脊髓照射的患兒,有時合併輕度的生理性腹瀉,對症治療即可。患者消化道症狀甚至在放療結束後3-6個月仍然存在。
② 循環系統:鞍區腫瘤患者多合併低鈉、低鉀血症,少數合併高鈉、高氯血症,放療中必須高度重視電解質的調節。
③ 血液系統:脊髓照射時患兒一般先有白細胞的下降,然後才是血小板和紅細胞的下降。放療期間提供高蛋白、高維生素的飲食是減輕放射性反應的簡單有效方法。
4.放射性損傷
中樞神經系統的放射性損傷是一個複雜過程,主要與照射體積、分次量、照射總量有關,而與治療時間關係不大,其損傷多為不可逆性的嚴重損傷,如放射性壞死。在生殖細胞腫瘤治療過程中,發生放射性壞死的病例多見於NG-MGCTs,由於此類腫瘤放療劑量常常在50-60Gy之間或更高,加之化療其晚期反應損傷更易出現。對於生殖細胞瘤如採用本文推薦的放療劑量,則發生嚴重的放射性損傷如放射性壞死的機率極少,更多見的是對患兒生長、發育的遲發性影響。
① 智力障礙 在放療後數月至數年發生的腦白質異常、脫髓鞘改變、微血管的鈣化及腦萎縮是MRI上最常見到的放射後的影像學改變。這些變化導致了患兒認知功能紊亂、IQ下降,嚴重的會產生較大的語言障礙,這些損傷的發生與年齡、照射劑量、單次量、照射體積、是否行化療均相關聯。
② 身高的影響 兒童接受脊髓照射時,有4個因素影響其成長過程中的身高。a生長激素(GH);b青春期的性腺分泌;c對骨骼生長的負面影響;d當睪丸或甲狀腺受照射時,發生功能減退。脊柱受照時,脊柱生長減慢,會出坐高較矮的現象。如果治療不包括脊髓,則放療後兒童的身高主要取決於GH。聯合放化療顯然會加重骨骼的生長緩慢。
因此,不進行全脊髓放療是最為有效的減少短脊柱發生方式。放化療綜合治療有效地減少了脊柱的照射量或不照射,對患者身高的影響較傳統的全腦全脊髓治療要好。
③ 甲狀腺 全腦全脊髓放療的位置接近甲狀腺,它有可能被照射導致甲狀腺功能低下,影響患兒生長發育
④ 性腺 研究表明:脊髓軸如果接受了35Gy的劑量,則睪丸卵巢接受的劑量分別為0.50-1.2Gy和0.9-l0Gy,由於睪丸和卵巢的位置不同,卵巢接受的劑量比睪丸要高。對患兒今後生育的影響,尚無足夠病例說明。
⑤ 其它 全脊髓照射時,內聽道受照導致中耳炎和聽力障礙;放療導致的繼發性腫瘤如腦膜瘤、膠質瘤及肉瘤均有不少報導。它的發生與放療劑量最密切,同時化療引起的基因損傷同樣可以誘發腫瘤的發生,如Sawarnara(1998)報告84例中有4例在放療後數年內生長了腦瘤,其中2例膠質母細胞瘤和2例腦膜瘤。應引起注意。
1.適應症:經組織學檢查確診的生殖細胞瘤者先採用化療,再補放療;顱內生殖細胞腫瘤術後和或放療後的補充治療;試驗性化療;NG-MGCTs術前的初始治療;顱內生殖細胞腫瘤復發的治療
2.毒副作用:化療藥物本身也有一定的毒性作用,如消化道症狀如噁心、嘔吐等、骨髓抑制、脫髮、肝腎毒性、聽神經損害、肺水腫和肺纖維化、出血等等。Chin報告指出不同化療藥物的毒性為博萊黴素有肺毒性,Vp-16可導致脫髮和繼發性白血病,長春花鹼有神經毒性,卡鉑可導致聽力減退和脊髓抑制。其中較嚴重的是骨髓抑制所導致的粒細胞減少和血小板減少症以及出血。故化療中需及時用相應的藥物來減少化療藥物的毒副作用十分必要。
松果體區腫瘤早期梗阻導水管而導致腦積水、腦室擴大,顱內壓增高,若腫瘤壓迫四疊體可有眼球垂直運動障礙、聽力減退;壓迫小腦上蚓部可走路不穩等,如考慮為典型的生殖細胞瘤,而顱內壓力增高症狀明顯者應先行側腦室-腹腔(V-P)分流,使顱內壓增高緩解後再行試驗性放療。如考慮畸胎瘤的可能性大則應V-P分流後7~10天直接行開顱手術來切除腫瘤。如V-P分流後病情加重應立即採用手術切除腫瘤來達到局部減壓。如意識障礙不嚴重,則可採用實驗性放療,亦可產生戲劇性效果。
1 .V-P分流
為解決顱壓增高、減少術中及術後導水管不通暢帶來的潛在危險,可先做V-P分流,這些病人在分流後可起到立竿見影的效果,腦室縮小,顱內壓降低,頭痛、嘔吐消失,對以後的治療安全有重要作用。但這種引流將腦室液引流到腹腔,有可能引起腫瘤在腹腔內種植
2.腦室鏡下腦室腦池造瘺術
對因松果體區生殖細胞腫瘤引起的梗阻性腦積水除用V-P分流外,也可採用內窺鏡技術,即在右額後部中線旁鑽孔,用腦室鏡插入側腦室額角,經室間孔進入三腦室,在乳頭體前方,漏斗隱窩三角的後壁造瘺,造瘺口直徑不小於5毫米,使腦室液與腳間池相通,可避免後者的一些併發症,如感染,引流管阻塞及腹腔內種植等。
3.直接手術切除腫瘤
主要有以下幾種原因:①疑畸胎瘤②放化療不敏感,腫瘤殘留較大③腫瘤巨大一般狀況差不宜首選放化療④腫瘤性質不易判斷,家屬要求或同意開顱手術切除或開顱活檢明確病理
(1)松果體區腫瘤的手術
松果體區位於顱腔的中心,其深在的定位使得腫瘤和中腦、丘腦、大腦內靜脈、大腦大靜脈、小腦前中央靜脈、四疊體等腦部重要結構產生密切的關係。無論何種入路,腫瘤與頭皮表面任何部位的距離幾乎是相等的,使腫瘤的暴露和切除十分困難。因此,在國內外,手術切除這一部位腫瘤,一向被認為是神經外科領域中難度大及危險性高的手術。面對這一難題,一個世紀以來國內外許多著名神經外科專家通過不懈努力,創造了許多種手術入路以切除松果體區腫瘤,並使這一部位腫瘤的手術死亡率和致殘率不斷下降,手術方法得到了逐漸的完善。
手術合併症主要有:深部靜脈損傷: 腫瘤與大腦內靜脈及大腦大靜脈關係密切,腫瘤剝
離時可引起靜脈破裂出血;術後血腫:多數因腫瘤切除不徹底而斷面出血;術後顱內壓增高:若腦室擴大加重及有顱內壓增高症狀,應及時行V-P分流。各具體手術入路的併發症可有所不同,應根據不同的手術方式加以預防。
(2) 鞍區腫瘤的手術
此部位腫瘤壓迫視神經和視交叉,損害垂體和下丘腦,巨大者可梗阻室間孔而有梗阻性腦積水,手術危險性也很大(主要是術後尿崩和電解質紊亂)。
主要術後合併症:下丘腦損傷.為在鞍區操作牽拉較重所致。但這種情況一旦發生則後果嚴重,表現為昏迷、消化道出血、呼吸淺快、血壓不升等,雖積極救治,但能存活者甚少;
水、電解質紊亂:為垂體柄損傷所致,因腫瘤較大,垂體柄多數受壓向後移位,有時受壓變扁及與腫瘤粘連,術中很難完整保留,術後電解質紊亂幾乎不可避免,故術中即可出現尿崩,術後當日尿崩可用彌凝或垂體後葉素,高鈉血症(常160~170mmol/l)應限鹽,用不含鈉鹽的葡萄糖液體輸入,每日檢查2次血生化,根據血鈉情況及時調整輸液。一般高鈉血症維持3~5天后即轉入低鈉血症,有時血鈉可低至110mmol/l,如不及時糾正低鈉血症,可出現低鈉導致的癲癇發作,嚴重者可為癲癇持續狀態,一般經補鈉後在5~7天逐漸恢復正常。
(3)基底節和丘腦腫瘤的手術
此部位腫瘤多為生殖細胞瘤,很少套用直接手術切除的方法。如為畸胎瘤則儘可能全切;如快速病理證實為生殖細胞瘤則可隨時終止手術,因切除範圍多少對患者的預後影響不大,有的病人腫瘤部分切除止血困難,全切除後才能止血滿意,主要術後合併症為偏癱。
疾病預防
SAWAMURA等(1998)按各種顱內生殖細胞腫瘤的預後將顱內生殖細胞腫瘤分為3大類:①預後好的顱內生殖細胞腫瘤包括單發的純生殖細胞瘤和成熟畸胎瘤, Sano(1995)報導的生殖細胞瘤的5年生存率為95%,十年生存率為91%。;②預後中等的顱內生殖細胞腫瘤包括伴β-HCG升高的生殖細胞瘤、多發的生殖細胞瘤、未成熟畸胎瘤、含生殖細胞瘤及成熟畸胎瘤或未成熟畸胎瘤成分的混合性生殖細胞腫瘤;③預後差的顱內生殖細胞腫瘤包括畸胎瘤惡性變、胚胎癌、內胚竇瘤、絨毛膜上皮癌、或含有上述惡性成分的混合性生殖細胞腫瘤。Jaing等(2001)通過多因素分析認為:與預後關係最密切的是顱內生殖細胞腫瘤的病理類型,生殖細胞瘤的5年生存率為92.6%,而NG-GCTs的5年生存率則為47.3%,
生殖細胞腫瘤的預後差別較大。顱內生殖細胞腫瘤預後與病理性質關係很大,生殖細胞瘤和成熟畸胎瘤預後最好;單純生殖細胞瘤可以治癒,多數文獻報導5年生存率超過90%,十年生存率達80%以上。未成熟和惡性畸胎瘤以及伴STGC的生殖細胞瘤預後次之;胚胎癌、絨癌、卵黃囊瘤和混合性生殖細胞腫瘤惡性程度最高,預後最差。高度惡性的生殖細胞腫瘤的治療和預後各家報導差異較大,何為最佳治療方案仍有待進一步研究。這是今後需要深入探討的一個重要課題。
單純生殖細胞瘤在治療結束後,應每3-6月隨診一次,除常規檢測血常規,生化,內分泌外,AFP和β-HCG和CT/MRI掃描是必須的,5年後隨訪間隔可改為6-12月。對NG-MGCTs,檢測AFP和β-HCG對判斷腫瘤復發具有重要的意義,如果AFP和β-HCG再次升高則可預測腫瘤的復發,其敏感性早於MRI。
