簡介
表征離子溶劑化的熱力學過程是成對的氣態離子進入溶劑中:
式中C+、A-為一對離子;g 表示氣態;s 表示溶劑化。由玻恩-哈伯循環可得到上述過程的熱力學性質的變化:
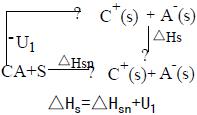 離子溶劑化
離子溶劑化式中S 為溶劑。根據測量的溶解熱△Hsn和晶格能U1,可以求出溶劑化熱△Hs
鄰近離子
水的結構在離子電場的作用下,鄰近離子的溶劑結構發生了變化,迄今還沒有實驗手段能得出確切的微觀圖象。另外,由於中心離子的特性、價型和半徑的不同,將導致與溶劑間相互作用和結構現象的差別,不同溶劑的性質差異更使問題複雜化,因此有著多種近似地描述離子近區溶劑結構的模型。圖1 描述水溶液中一個半徑不大的簡單離子的模型。它把鄰近離子的水的結構看成三個區域:①結構形成區,該區緊靠離子,該區中的水分子沿著離子電場取向,它們是隨同中心離子運動的。②結構破壞區,它鄰接結構形成區,在這個區域內,溶劑本體的正常結構有一定程度的改變,但這些水分子不參與離子的平移運動。③本體區,為距離離子足夠遠的區域,在這個區域內,離子電場不足以對溶劑結構產生影響,水依然體現如同本體一樣的四面體向鍵接網路的結構特徵和動態性質。
溶劑化數
在溶液中與離子締合的溶劑分子數n 稱溶劑化數。以水溶液為例,離子淌度實驗表明,在離子運動過程中,表現有一個水殼層隨同,根據這殼層體積就可得出該離子的水化數n′;由離子水化熵的實驗值,可得到與離子結合而失去平動自由度的水分子數;由溶液的壓縮係數實驗,可得出由於離子電場的強烈電縮效應,在一定範圍的外壓影響下不再發生體積變化
的水分子數。另外,介電性質、偏摩爾體積測量等方法所得的n 值也不完全一致,但反映的都是那些與離子牢固締合的水分子數,稱為一級(原)水化數n1。
與圖1 中結構形成區對應的殼層稱原水化層,在它的外面,有更多的水分子不同程度地受離子電場的影響,發生二級水化。有的性質(如水的活度係數)所導出的水化數遠大於離子的配位水分子數(4,6),這是由於這項性質反映了二級水化部分。
理論
理論上,把離子相互作用能大於某一界限的水分子定義為水化水,從而得出水化數的計算值。
 離子溶劑化
離子溶劑化離子水化能的計算根據一定的模型可對離子水化吉布斯函式、焓和熵的變數△Gi-s、△Hi-s、△Si-s進行理論計算。i-s 表示離子-溶劑相互作用。計算可達到兩個目的,一是將計算結果與實驗結果進行比較.以便深入認識離子-溶劑相互作用的機理;二是求得單一離子的某些熱力學函式值。所用模型有連續介質模型和分立的分子模型。溶劑化數隨溫度升高而降低 ,鋰離子與溶劑分子之間發生了強烈的相互作用 。
連續介質模型1920 年M,玻恩把溶劑看作連續介質,其性質完全由溶劑本體的介電常數D 體現,把離子看作半徑為r1和帶有電荷 Zie0的圓球。溶劑化吉布斯函式的定義是,把1 摩爾自由離子從真空轉移到溶劑中的吉布斯函式變化,它所對應的就是離子-溶劑相互作用。玻恩假設把求取溶劑化吉布斯函式歸結為帶電圓球自真空至介質的轉移功的計算,這個計算可由圖2 示。
意的循環實現
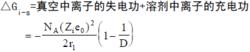 離子溶劑化
離子溶劑化根據能量守恆定律,圖2 中四項功的代數和為零,從而得出:
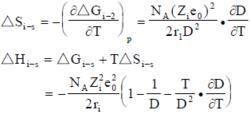 離子溶劑化
離子溶劑化式中NA為阿伏伽德羅數。根據熱力學關係可得出溶劑化熵和焓的計算式:
式中T 為熱力學溫度;p 為壓力。
分立的分子模型1933 年J.D.伯納爾和R.H.否勒奠定了這類模型和計算步驟的基礎,圖3 是他們提出的離子和鄰接水分子間相互作用的模型。圖中表明,與離子鄰接配位水分子數為4,水分子所處位置是正四面體的頂角,水分子偶極矩沿離子電場完全取向,兩個氫鍵方向朝著中心離子;另外兩個氫鍵方向朝著結構破壞區(圖1)。上述處理中,以這些成氫鍵位置與結構
破壞區水分子形成氫鍵代表結構形成區和結構破壞區溶劑間的相互作用。
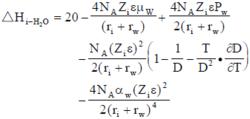 離子溶劑化
離子溶劑化J.O.博克里斯建議用下式表達正離子溶劑化熱:
負離子水化熱的表達式為:
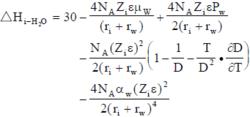 離子溶劑化
離子溶劑化式中μw為水分子的偶極矩;ε為介電常數;Pw為水分子四極矩;αw為水分子的極化率;γw為水分子的半徑。上面兩個公式是按1 摩爾離子和4摩爾水分子計量的,第一項為經驗項;第二項為離子-水分子偶極矩相互作用;第三項為離子-水分子四極矩相互作用;第四項為博恩過程靜電功;第五項為離子-水分子誘導偶極矩相互作用。

