吸附試驗
簡介
 酶聯免疫吸附試驗專用儀器
酶聯免疫吸附試驗專用儀器自從Engvall和Perlman(1971)首次報導建立酶聯免疫吸附試驗(Enzyme-Linked ImmunosorbentAssays,ELISA)以來,由於ELISA具有快速、敏感、簡便、易於標準化等優點,使其得到迅速的發展和廣泛套用。儘管早期的ELISA由於特異性不夠高而妨礙了其在實際中套用的步伐,但
隨著方法的不斷改進、材料的不斷更新,尤其是採用基因工程方法製備包被抗原,採用針對某一抗原表位的單克隆抗體進行阻斷ELISA試驗,都大大提高了ELISA的特異性,加之電腦化程度極高的ELISA檢測儀的使用,使ELISA更為簡便實用和標準化,從而使其成為最廣泛套用的檢測方法之一。
如今ELISA方法已被廣泛套用於多種細菌和病毒等疾病的診斷。在動物檢疫方面,ELISA在豬傳染性胃腸炎、牛副結核病、牛傳染性鼻氣管炎、豬偽狂犬病、藍舌病等的診斷中已為廣泛採用的標準方法。
基本原理
ELISA方法的基本原理是酶分子與抗體或抗抗體分子共價結合,此種結合不會改變抗體的免疫學特性,也不影響酶的生物學活性。此種酶標記抗體可與吸附在固相載體上的抗原或抗體發生特異性結合。滴加底物溶液後,底物可在酶作用下使其所含的供氫體由無色的還原型變成有色的氧化型,出現顏色反應。因此,可通過底物的顏色反應來判定有無相應的免疫反應,顏色反應的深淺與標本中相應抗體或抗原的量呈正比。此種顯色反應可通過ELISA檢測儀進行定量測定,這樣就將酶化學反應的敏感性和抗原抗體反應的特異性結合起來,使ELISA方法成為一種既特異又敏感的檢測方法。
特性
用於標記抗體或抗抗體的酶須具有下列特性:有高度的活性和敏感性;在室溫下穩定;反應產物易於顯現;能商品化生產。如今套用較多的有辣根過氧化物酶(HRP)、鹼性磷酸酶、葡萄糖氧化酶等,其中以HRP套用最廣。
辣根過氧化物酶
過氧化物酶(HRP)廣泛分布於植物中,辣根中含量最高,從辣根中提取的稱辣根過氧化物酶(HRP),是由無色酶蛋白和深棕色的鐵卟啉構成的一種糖蛋白(含糖量18%),分子量約40 000,約由300個胺基酸組成,等電點為pH 3-9,催化反應的最適pH值因供氫體不同而稍有差異,一般多在pH 5左右。此酶溶於水和50%飽和度以下的硫酸銨溶液。酶蛋白和輔基的最大吸收光譜分別為275nm和403nm。
酶的純度以RZ表示:RZ=OD403/OD275
純酶的RZ多在3.0以上,最高為3.4。RZ在0.6以下的酶製品為粗酶,非酶蛋白約占 75%,不能用於標記。RZ在2.5以上者方可用於標記。HRP的作用底物為過氧化氫,催化反應時的供氫體有幾種:⑴鄰苯二胺(OPD),產物為橙色,可溶性,敏感性高,最大吸收值在490nm,可用肉眼觀察判別,容易被濃硫酸終止反應,顏色可在數小時內不改變,是目前國內ELISA中最常用的一種;⑵聯大茴香胺(OD),產物為橘黃色,最大吸收值在400nm,顏色較穩定;⑶5-氨基水楊酸(5-AS):產物為深棕色,最大吸收值在449nm,部分溶解,敏感性較差;⑷鄰聯甲苯胺(OT)產物為藍色,最大吸收值在630nm,部分溶解,不穩定,不耐酸,但反應快,顏色明顯。
鹼性磷酸酶
系從小牛腸黏膜和大腸桿菌中提取,由多個同功酶組成。它們的底物種類很多,常用者為硝基苯磷酸鹽,廉價無毒性。酶解產物呈黃色,可溶,最大吸收值在400nm。酶的活性以在pH10反應系統中,37℃1分鐘水解1μg磷酸苯二鈉為一個單位。
標記方法
良好的酶結合物取決於兩個條件:即高效價的抗體和高活性的酶。抗體的活性和純度對製備標記抗體至關重要,因為特異性免疫反應隨抗體活性和純度的增加而增強。在酶標記過程中,抗體的活性有所降低,故需要純度高、效價高及抗原親和力強的抗體球蛋白,最好使用親和層析提純的抗體,可提高敏感性,而且可稀釋使用,減少非特異性吸附。
酶與抗體交聯,常用戊二醛法和過碘酸鹽氧化法。郭春祥建立的HRP標記抗體的改良過碘酸鈉法簡單易行,標記效果好,特別適用於實驗室的小批量製備。其標記程式為:將5μg HRP溶於0.5ml蒸餾水中,加入新鮮配製的0.06 mol/L的過碘酸鈉(NaIO4)水溶液0.5ml,混勻置4℃冰櫃30分鐘 , 取出加入0.16mol/L的乙二醇水溶液0.5ml,室溫放置30分鐘後加入含5g純化抗體的水溶液1ml,混勻並裝透析袋,以0.05mol/L、pH9.5的碳酸鹽緩衝液於4℃冰櫃中慢慢攪拌透析6小時(或過夜)使之結合,然後吸出,加硼氫化鈉(NaBH4)溶液(5(g/ml)0.2ml,置4℃冰櫃2小時,將上述結合物混合液加入等體積飽和硫酸銨溶液,置4℃冰櫃30分鐘後離心,將所得沉澱物溶於少許0.02mol/L、pH7.4PBS中,並對之透析過夜(4℃),次日離心除去不溶物,即得到酶標抗體,用0.02mol/L、pH7.4PBS稀至5ml,進行測定後,冷凍乾燥或低溫保存。
效果測定
測定內容包括酶和抗體活性、結合物中酶含量和IgG含量、酶與IgG摩爾比值以及結合率。
⑴ 酶與抗體的活性常用瓊脂擴散或免疫電泳法,使抗原與抗體形成沉澱線,經PBS漂洗1天,再以蒸餾水浸泡1小時,將瓊脂凝膠片浸於酶底物溶液中著色,如果出現應有的顏色反應,再用生理鹽水浸泡,顏色仍然不褪,表示結合物既有酶的活性,也有抗體活性。良好的結合物在顯色後,瓊擴滴度應在1:16以上。另一個測定方法是用系列稀釋的酶標抗體直接以ELISA方法進行方陣滴定,此法不僅可以測定標記效果,還可以確定酶標抗體的使用濃度。
⑵ 結合物的定量測定一般是對結合物中的酶和IgG進行定量測定。常用紫外分光光度計於403nm和280nm進行測定,然後按下列公式計算:
酶量(mg/ml)=OD403×0.42
IgG量(mg/ml)=(OD280-OD403×0.4)×0.94×0.62
對於過碘酸鈉氧化法製備的標記抗體量,按下列公式計算:
IgG量(mg/ml)=(OD280-OD403×0.34)×0.62
已知酶量和IgG量後,即可計算出標記抗體的摩爾(mol)比值。
HRP/IgG摩爾比值=HRP(mg/ml)/IgG(mg/ml)×4
結合物中酶總量=HRP(mg/ml)×結合物溶液量
結合物產率=結合物中酶總量/標記時加入的酶量×100%
用於ELISA的結合物的酶量為400(g/ml時效果一般,為500(g/ml時效果較好,達 1000(g/ml時效果最好。mol.比值由於結合物中含的IgG並不完全可靠,所以不能作為主要參數。一般認為mol.比值為0.7時效果一般,1.0時效果較好,1.5-2.0時最好。酶結合率為 7%時效果一般,為9%-10%較好,達30%以上時最好。
ELISA方法的基本類型、用途及操作程式
根據ELISA所用的固相載體而區分為三大類型:一是採用聚苯乙烯微量板為載體的ELISA,即我們通常所指的ELISA(微量板ELISA);另一類是用硝酸纖維膜為載體的ELISA,稱為斑點ELISA(Dot-ELISA);再一類是採用疏水性聚脂布作為載體的ELISA,稱為布ELISA(C-ELISA)。在微量板ELISA中,又根據其性質不同分為間接ELISA、雙抗體夾心ELISA、雙夾心ELISA、競爭ELISA、阻斷ELISA及抗體捕捉ELISA。
間接ELISA
本法主要用於檢測抗體。以鴨病毒性肝炎(DVH)抗體的ELISA為例,間接ELISA的操作程式如下。
⑴ 材料
① 包被液、洗滌液、保溫液、底物液、終止液;
② DVH包被抗原、酶標抗抗體、陰性及陽性DVH參考血清;待檢鴨血清;
③ ELISA檢測儀、加樣器、聚苯乙烯微量板。
⑵ 方法步驟
① 加抗原包被 → 4℃過夜,洗滌三次、拋乾
② 加待檢血清 → 37℃ 2小時,洗滌三次、拋乾
③ 加酶標抗體 → 37℃ 2小時,洗滌三次、拋乾
④ 加底物液→ 37℃ 30分鐘,加終止液
⑤ 用ELISA檢測儀測定OD值,並計算出P/N比值。
⑶ 結果判定已知陽性血清與已知陰性血清的比值(P/N)≥2.1,而且已知陽性血清的OD值≥0.4;在上述條件成立的情況下,如果待檢血清與已知陰性血清的比值(P/N)≥2.1,而且待檢血清的OD值≥0.4,則判為陽性,否則判為陰性。
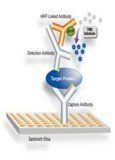
雙抗體夾心
本法主要用於檢測大分子抗原。現以檢測雞傳染性法氏囊病病毒(IBDV)的雙夾心抗體ELISA為例介紹本法的操作程式。
① 加抗體包被 → 4℃過夜,洗滌三次、拋乾
② 加待檢抗原 → 37℃ 30分鐘,洗滌三次、拋乾
③ 加酶標抗體 → 37℃ 30分鐘,洗滌三次、拋乾
④ 加底物液→ 37℃ 15分鐘,加終止液
⑤ 用ELISA檢測儀測定OD值。
雙夾心ELISA
此法與雙抗體夾心ELISA的主要區別在於:它是採用酶標抗抗體檢查多種大分子抗原,它不僅不必標記每一種抗體,還可提高試驗的敏感性。此法的基本程式為:
① 加抗體(Ab-1)包被 → 4℃過夜,洗滌三次、拋乾
② 加待檢抗原(Ag) → 37℃ 60分鐘,洗滌三次、拋乾
③ 加用非同種動物生產的特異性抗體(Ab-2)→ 37℃ 60分鐘,洗滌三次、拋乾
④ 加入酶標抗Ab-2抗體(AB-3)→ 37℃ 60分鐘,洗滌三次、拋乾
⑤ 加底物液 → 37℃ 20分鐘,加終止液
⑥ 用ELISA檢測儀測定OD值。
競爭ELISA
此法主要用於測定小分子抗原及半抗原,其原理類似於放射免疫測定。其基本程式為:
① 抗體包被 → 4℃過夜,洗滌三次、拋乾
② 加入待檢抗原及一定量的酶標抗原(對照孔僅加酶標抗原)→ 37℃ 60分鐘,洗滌三次、拋乾
③ 加底物液 → 37℃ 20分鐘,加終止液
④ 用ELISA檢測儀測定OD值。
被結合的酶標抗原的量由酶催化底物反應產生有色產物的量來確定,如果待檢溶液中抗原越多,被結合的標記抗原的量就越少,有色產物就減少,這樣根據有色產物的變化就可求出未知抗原的量。此法的優點在於快速、特異性高、且可用於小分子抗原及半抗原的檢測;其主要不足在於每種抗原都要進行酶標記,而且因為抗原的結構不同,還需套用不同的結合方法。此外,試驗中套用酶標抗原的量較多。
阻斷ELISA
本法主要用於檢測型特異性抗體。該方法現已成為豬傳染性胃腸炎(TGE)、豬偽狂犬病(PR)及豬胸膜肺炎(AP)的主要檢測方法。下面以AP2型抗體的阻斷ELISA檢測法為例介紹其操作程式:
① 100μl AP2型工作量抗原包被 → 4℃過夜,洗滌三次、拋乾
② 用200μl阻斷緩衝液進行封閉 → 37℃ 60分鐘,洗滌三次、拋乾
③ 加工作量1:4稀釋被檢豬血清100μl → 37℃ 60分鐘,洗滌三次、拋乾
④ 加100μl工作量兔抗AP2型血清 → 37℃ 30分鐘,洗滌三次、拋乾
⑤ 加100μl工作量豬抗兔IgG-HRP → 37℃ 60分鐘,洗滌三次、拋乾
⑥ 加100μl OPD底物液 → 37℃ 20分鐘,加終止液
⑦ 用ELISA檢測儀測定OD值。
本試驗同時設標準陰、陽性血清對照、兔抗AP2型陽性對照、空白對照。
抗體捕捉ELISA
本法主要用於檢測IgM抗體。由於IgM抗體出現於感染早期,所以檢測出IgM,則可作為某種疾病的早期診斷。抗體捕捉ELISA根據所用標記方式不同可分為標記抗原、標記抗體、標記抗抗體捕捉ELISA等幾種,其中以標記抗原捕捉ELISA比較有代表性,該方法的主要程式為:
① 用抗u鏈(抗IgM重鏈)抗體包被→37℃ 60分鐘後置4℃過夜,洗滌三次、拋乾
② 加待檢血清 → 37℃ 2小時,洗滌三次、拋乾
③ 加酶標抗原 → 37℃ 60分鐘,洗滌三次、拋乾
④ 加底物液 → 37℃ 20分鐘,加終止液
⑤ 用ELISA檢測儀測定OD值。
斑點ELISA
與常規的微量板ELISA比較,Dot-ELISA具有簡便、節省抗原等優點,而且結果可長期保存;但其也有不足,主要是在結果判定上比較主觀,特異性不夠高等。該方法的主要操作程式為:
⑴載體膜的預處理及抗原包被取硝酸纖維素膜用蒸餾水浸泡後,稍加乾燥進行壓圈。將陰性、陽性抗原及被檢測抗原適度稀釋後加入圈中,置37℃使硝酸纖維素膜徹底乾燥。每張7cm×2.3cm的膜一般可點加40-53個樣品,每個壓圈可加抗原液1-20μl。
⑵ 封閉將硝酸纖維素膜置於封閉液中,37℃感作15-30分鐘。封閉液多採用含有正常動物血清、pH7.2或pH7.4的PBS。
⑶ 加被檢血清可直接在抗原圈上加,也可剪下抗原圈、置於微量板孔中,再加入一定量適度稀釋的待檢血清,37℃反應一定時間,用洗滌液洗三次,每次1-3分鐘。洗滌液一般為一定濃度的PBS-Tween溶液。
⑷ 加酶標抗體,37℃反應一定時間後,用洗滌液洗三次。
⑸顯色加入新鮮配製的底物液,37℃反應一定時間後,去掉底物液,加蒸餾水洗滌終止反應。
⑹ 結果判定以陽性、陰險血清作為對照,膜片中央出現深棕紅色斑點者為陽性反應,否則為陰性反應。
布ELISA
(C-ELISA)C-ELISA(Cloth-ELISA)是加拿大學者Blais,B. W.等於1989年建立的一種新型免疫檢測技術。該方法是以疏水性聚脂布(Hydrophobic Polyester Cloth)即滌綸布為固相載體,這種大孔徑的的疏水布具有吸附樣品量大,可為免疫反應提供較大的表面積,提高反應的敏感性,且容易洗滌,不需特殊儀器等優點。其基本原理與Dot-ELISA類似,只是載體不同。以對布氏桿菌抗原的檢測為例,C-ELISA的主要程式為:
⑴ 首先把抗布氏桿菌的血清包被(吸附)在聚脂布上,並經洗滌及封閉;
⑵ 加被檢樣品並於室溫下感作30分鐘,然後洗5次;
⑶ 加酶標記的抗布氏桿菌抗體,於室溫下感作30分鐘,然後洗滌5次;
⑷ 加入底物液顯色;
⑸ 測定OD值。
影響因素
酶聯免疫(ELISA)是如今檢驗科常用的免疫學檢測方法之一,其操作簡單,無須特殊設備,使其在各級醫院都有套用。但是,如果忽視了影響其結果的因素,難免會造成假陰性或假陽性,因此,了解影響實驗的因素,減少差錯事故的發生是極其必要的。
素質因素
實驗室人員的素質主要包括五個方面:思想素質、文化素質、技術素質、心理素質、身體素質。首先應具備一個良好的思想素質,因為我們的服務對象是人,我們的道德水平直接關係到人們的健康和生命安危,如果馬馬虎虎。三心二意,難免會有差錯事故發生,我們應該熱愛專業,耐心細緻。在工作中如標本混淆、張冠李戴、報告單發錯等都有可能造成嚴重後果;其次文化素質和技術素質,我們要熟練掌握本專業的基本理論和基本技術,認真學習新理論新知識,努力提高自己的業務水平,創造一個能夠勝任本職工作的技術平台。良好的心理素質就是要勇於面對工作生活中的挫折,在繁忙工作中,有條不紊,冷靜沉著的處理有關事務。人員素質問題是影響檢驗結果的首要因素。
標本處理因素
實驗室人員收到標本後應認真查對,對不符合要求的標本和申請單要拘收,合格標本要及時分離血清,避免溶血,提取血清時不應混有大量纖維蛋白或細胞成分。對不能及時檢測的標本要妥善保存於4℃冰櫃,做好原始記錄,標本管上最好標上待檢者姓名、日期。從冰櫃取出的標本要預溫至室溫,對冰凍的樣品要融化好,並充分混勻再用。
注意事項
1、操作前應對實驗的物理參數有充分的了解,如環境溫度(保持在18 C~25℃)、反應孵育溫度和孵育時間、洗滌的次數等,要先查看水育箱溫度,是否符合要求。
2、正確使用加樣器加樣器應垂直加入標本或試劑,避免刮擦包被板底部。加樣過程中避免液體外濺,血清殘留在反應孔壁上,加樣器吸頭要清洗乾淨,避免污染,加樣次序要與說明書一致,否則可導致結果錯誤,實驗重複性差。
3、手工洗板加洗液時衝擊力不要太大,洗滌次數不要超過說明書推薦的洗滌次數,洗液在反應孔內滯留的時間不宜太長。不要使洗液在孔間竄流,造成孔問污染,導致假陰性或假陽性。
4、要保證加液量一致 我們在使用時感覺滴瓶加液不如加樣器好,滴瓶不易控制加液量不準,造成顯色不統一,判斷錯誤。
5、顯色液量不可過多 加樣的工作環境不能處於陽光直射的環境下,加顯色系統後要避光反應,顯色液量不能過多,以免顯色過強。
6、試劑的影響因數:應選用有國家批准文號,質量靠得住的產品,不能圖便宜,忽視質量保證。試劑應妥善保存於4℃冰櫃內,在使用時先平衡至室溫,不同批號的試劑組分不宜交叉使用。試劑開啟後要在一周內用完,剩餘的試劑下次用時應先檢查是否變質,,顯色劑如被污染變色將造成全部顯色,導致錯誤結果。過期的試劑不宜再用,若別無選擇,應做好雙份質控品的監測,確保結果的可靠性。
不良反應與風險
暫無相關併發症和危害。