基本概念
 質粒
質粒細胞複製
 質粒
質粒質粒載體
 質粒
質粒質粒載體是在天然質粒的基礎上為適應實驗室操作而進行人工構建的。與天然質粒相比,質粒載體通常帶有一個或一個以上的選擇性標記基因(如抗生素抗性基因)和一個人工合成的含有多個限制性內切酶識別位點的多克隆位點序列,並去掉了大部分非必需序列,使分子量儘可能減少,以便於基因工程操作。大多質粒載體帶有一些多用途的輔助序列,這些用途包括通過組織化學方法肉眼鑑定重組克隆、產生用於序列測定的單鏈DNA、體外轉錄外源DNA序列、鑑定片段的插入方向、外源基因的大量表達等。一個理想的克隆載體大致應有下列一些特性:⑴分子量小、多拷貝、鬆弛控制型;⑵具有多種常用的限制性內切酶的單切點;⑶能插入較大的外源DNA片段;⑷具有兩個以上的遺傳標記物,便於鑑定和篩選。⑸對宿主細胞無害。常用的質粒載體大小一般在1kb至10kb之間,如PBR322、PUC系列、PGEM系列和pBluescript(簡稱pBS)等。
不兼容性
利用同一複製系統的不同質粒不能在同一宿主細胞中共同存在,當兩種質粒同時導入同一細胞時,它們在複製及隨後分配到子細胞的過程中彼此競爭。在一些細胞中,一種質粒占優勢,而在另一些細胞中另一種質粒卻占上風。當細胞生長几代後,占少數的質粒將會丟失,因而在細胞後代中只有兩種質粒的一種,這種現象稱質粒的不相容性(Incompatibility)。但利用不同複製系統的質粒則可以穩定地共存於同一宿主細胞中。質粒通常含有編碼某些酶的基因,其表型包括對抗生素的抗性,產生某些抗生素,降解複雜有機物,產生大腸桿菌素和腸毒素及某些限制性內切酶與修飾酶等。提取方法
從細菌中分離質粒DNA的方法都包括3個基本步驟:培養細菌使質粒擴增;收集和裂解細胞;分離和純化質粒DNA。採用強鹼液、加熱或溶菌酶(主要針對革蘭氏陽性細菌)可以破壞菌體細胞壁,十二烷基磺酸鈉(SDS)和TritonX-100(一般很少使用)可使細胞膜裂解。經溶菌酶和SDS或Triton X-100處理後,細菌染色體DNA會纏繞附著在細胞碎片上,同時由於細菌染色體DNA比質粒大得多,易受機械力和核酸酶等的作用而被切斷成不同大小的線性片段。當用強熱或酸、鹼處理時,細菌的線性染色體DNA變性,而共價閉合環狀DNA(CovalentlyclosedcircularDNA,簡稱cccDNA)的兩條鏈不會相互分開,當外界條件恢復正常時,線狀染色體DNA片段難以復性,而是與變性的蛋白質和細胞碎片纏繞在一起,而質粒DNA雙鏈又恢復原狀,重新形成天然的超螺鏇分子,並以溶解狀態存在於液相中。在細菌細胞內,共價閉環質粒以超螺鏇形式存在。在提取質粒過程中,除了超螺鏇DNA外,還會產生其它形式的質粒DNA。如果質粒DNA兩條鏈中有一條鏈發生一處或多處斷裂,分子就能鏇轉而消除鏈的張力,形成鬆弛型的環狀分子,稱開環DNA(OpencircularDNA,簡稱ocDNA);如果質粒DNA的兩條鏈在同一處斷裂,則形成線狀DNA(LinearDNA)。當提取的質粒DNA電泳時,同一質粒DNA其超螺鏇形式的泳動速度要比開環和線狀分子的泳動速度快。分離操作
從細菌中分離質粒DNA的具體操作材料設備試劑
一、材料含PBS的E.coliDH5α或JM系列菌株,1.5ml塑膠離心管(又稱eppendorf管),離心管架。
二、設備
微量取液器(20μl,200μl,1000μl),台式高速離心機,恆溫振盪搖床,高壓蒸汽消毒器(滅菌鍋),渦鏇振盪器,電泳儀,瓊脂糖平板電泳裝置和恆溫水浴鍋等。
三、試劑
1、LB液體培養基(Luria-Bertani):稱取蛋白腖(Tryptone)10g,酵母提取物(Yeastextract)5g,NaCl10g,溶於800ml去離子水中,用NaOH調pH至7.5,加去離子水至總體積1升,高壓下蒸氣滅菌20分鐘。
2、LB固體培養基:液體培養基中每升加12g瓊脂粉,高壓滅菌。
3、氨苄青黴素(Ampicillin,Amp)母液:配成50mg/ml水溶液,-20℃保存備用。
4、溶菌酶溶液:用10mmol/LTris·Cl(pH8.0)溶液配製成10mg/ml,並分裝成小份(如1.5ml)保存於-20℃,每一小份一經使用後便予丟棄。
5、3mol/lNaAc(pH5.2):50ml水中溶解40.81gNaAc·3H2O,用冰醋酸調pH至5.2,加水定容至100ml,分裝後高壓滅菌,儲存於4℃冰櫃。
6、溶液1:50mmol/L葡萄糖,25mmol/LTris.Cl(pH8.0),10mmol/LEDTA(pH8.0)。溶液Ⅰ可成批配製,每瓶100ml,高壓滅菌15分鐘,儲存於4℃冰櫃。
7、溶液Ⅱ:0.2mol/LNaOH(臨用前用10mol/LNaOH母液稀釋),1%SDS。
8、溶液Ⅲ:5mol/LKAc60ml,冰醋酸11.5ml,H2O28.5ml,定容至100ml,並高壓滅菌。溶液終濃度為:K+3mol/L,Acˉ5mol/L。
9、RNA酶A母液:將RNA酶A溶於10mmol/LTris·Cl(pH7.5),15mmol/LNaCl中,配成10mg/ml
的溶液,於100℃加熱15分鐘,使混有的DNA酶失活。冷卻後用1.5mleppendorf管分裝成小份保存於-20℃。
10、飽和酚:市售酚中含有醌等氧化物,這些產物可引起磷酸二酯鍵的斷裂及導致RNA和DNA的交聯,應在160℃用冷凝管進行重蒸。重蒸酚加入0.1%的8-羥基喹啉(作為抗氧化劑),並用等體積的0.5mol/LTris·Cl(pH8.0)和0.1mol/LTris·Cl(pH8.0)緩衝液反覆抽提使之飽和並使其pH值達到7.6以上,因為酸性條件下DNA會分配於有機相。
11、氯仿:按氯仿:異戊醇=24:1體積比加入異戊醇。氯仿可使蛋白變性並有助於液相與有機相的分開,異戊醇則可起消除抽提過程中出現的泡沫。按體積/體積=1:1混合上述飽和酚與氯仿即
得酚/氯仿(1:1)。酚和氯仿均有很強的腐蝕性,操作時應戴手套。
12、TE緩衝液:10mmo/LTris·Cl(pH8.0),1mmol/LEDTA(pH8.0)。高壓滅菌後儲存於4℃冰櫃中。
13、STET:0.1mol/LNaCl,10mmol/LTris·Cl(pH8.0),10mmol/LEDTA(pH8.0),5%TritonX-100。
14、STE:0.1mol/LNaCl,10mmol/LTris·Cl(pH8.0),1mmol/LEDTA(pH8.0)。
15、電泳所用試劑:⑴TBE緩衝液(5×):稱取Tris54g,硼酸27.5g,並加入0.5MEDTA(pH8.0)20ml,定溶至1000ml。⑵上樣緩衝液(6×):0.25%溴酚藍,40%(w/v)蔗糖水溶液。
操作步驟
一、細菌的培養和收集將含有質粒pBS的DH5α菌種接種在LB固體培養基(含50μg/mlAmp)中,37℃培養12-24小時。用無菌牙籤挑取單菌落接種到5mlLB液體培養基(含50μg/mlAmp)中,37℃振盪培養約12小時至對數生長後期。
二、質粒DNA少量快速提取
質粒DNA小量提取法對於從大量轉化子中製備少量部分純化的質粒DNA十分有用。這些方法共同特點是簡便、快速,能同時處理大量試樣,所得DNA有一定純度,可滿足限制酶切割、電泳分析的需要。
(一)、煮沸法
1、將1.5ml培養液倒入eppendorf管中,4℃下12000g離心30秒。
2、棄上清,將管倒置於衛生紙上幾分鐘,使液體流盡。
3、將菌體沉澱懸浮於120mlSTET溶液中,渦鏇混勻。
4、加入10ml新配製的溶菌酶溶液(10mg/ml),渦鏇振盪3秒鐘。
5、將eppendorf管放入沸水浴中,50秒後立即取出。
6、用微量離心機4℃下12000g離心10分鐘。
7、用無菌牙籤從eppendorf管中去除細菌碎片。
8、取20ml進行電泳檢查。
[注意]1.對大腸桿菌可從固體培養基上挑取單個菌落直接進行煮沸法提取質粒DNA。2.煮沸法中添加溶菌酶有一定限度,濃度高時,細菌裂解效果反而不好。有時不同溶菌酶也能溶菌。3.提取的質粒DNA中會含有RNA,但RNA並不干擾進一步實驗,如限制性內切酶消化,亞克隆及連線反應等。
(二)、鹼法
1、取1.5ml培養液倒入1.5mleppendorf管中,4℃下12000g離心30秒。
2、棄上清,將管倒置於衛生紙上數分鐘,使液體流盡。
3、菌體沉澱重懸浮於100μl溶液Ⅰ中(需劇烈振盪),室溫下放置5-10分鐘。
4、加入新配製的溶液Ⅱ200μl,蓋緊管口,快速溫和顛倒eppendorf管數次,以混勻內容物(千萬不要振盪),冰浴5分鐘。
5、加入150μl預冷的溶液Ⅲ,蓋緊管口,並倒置離心管,溫和振盪10秒,使沉澱混勻,冰浴中5-10分鐘,4℃下12000g離心5-10分鐘。
6、上清液移入乾淨eppendorf管中,加入等體積的酚/氯仿(1:1),振盪混勻,4℃下12000g離心5分鐘。
7、將水相移入乾淨eppendorf管中,加入2倍體積的無水乙醇,振盪混勻後置於-20℃冰櫃中20分鐘,然後4℃下12000g離心10分鐘。
8、棄上清,將管口敞開倒置於衛生紙上使所有液體流出,加入1ml70%乙醇洗沉澱一次,4℃下12000g離心5-10分鐘。
9、吸除上清液,將管倒置於衛生紙上使液體流盡,真空乾燥10分鐘或室溫乾燥。
10、將沉澱溶於20μlTE緩衝液(pH8.0,含20μg/mlRNaseA)中,儲於-20℃冰櫃中。
[注意]1.提取過程應儘量保持低溫。2.提取質粒DNA過程中除去蛋白很重要,採用酚/氯仿去除蛋白效果較單獨用酚或氯仿好,要將蛋白儘量除乾淨需多次抽提。3.沉澱DNA通常使用冰乙醇,在低溫條件下放置時間稍長可使DNA沉澱完全。沉澱DNA也可用異丙醇(一般使用等體積),且沉澱完全,速度快,但常把鹽沉澱下來,所以多數還是用乙醇。
(三)、Wizard少量DNA純化系統
Promega公司的Wizard少量DNA純化系統可快速有效的抽提質粒DNA,整個過程只需15分鐘。提取的質粒可直接用於DNA測序、酶切分析和體外轉錄等。該系統中所含試劑和柱子可以用於50次1-3ml質粒培養液的分離和純化,試劑包括10ml細胞懸浮液,10ml細胞裂解液;10ml中和液,50mlWizard少量DNA純化樹脂,50ml柱洗液(使用前加95%乙醇至120ml)和50支Wizard微型柱。
1、1-3ml過夜培養細胞液4℃下12000g離心1-2分鐘。
2、去除上清液,菌體細胞懸浮於200μl細胞懸浮液中,充分混合,並移入eppendorf管中。
3、加200μl細胞裂解液,顛倒離心管數次,直到溶液變清亮。
4、加200μl中和液,顛倒離心管數次。
5、4℃下12000g離心5分鐘,取上清液於新的eppendorf管中。
6、加1mlWizard少量DNA純化樹脂,顛倒離心管數次以充分混勻。
7、取一次性注射器,取出注塞,並使注射筒與Wizard微型柱連線,用移液槍將上述混合液加入注射筒中,並用注塞輕推,使混合物進入微型柱。
8、將注射器與微型柱分開,取出注塞,再將注射筒與微型柱相連,加入2ml柱洗液,並用注塞輕推,使柱洗液進入微型柱。
9、取出微型柱置於eppendorf管中,離心2分鐘以除去微型柱中的柱洗液。
10、將微型柱放在一個新eppendorf管中,加50μlTE(或水)於微型柱中,靜止1分鐘後,4℃下12000g離心20秒。
11、丟棄微型柱,將eppendorf管中的質粒DNA貯於4℃或-20℃冰櫃。
[注意]樹脂使用前應充分混勻,如有結晶,可將樹脂用25-37℃水浴處理10分鐘。
三、質粒DNA的大量提取和純化
在製作酶譜、測定序列、製備探針等實驗中需要高純度、高濃度的質粒DNA,為此需要大量提取質粒DNA。大量提取的質粒DNA一般需進一步純化,常用柱層析法和氯化絕梯度離心法。
(一)、鹼法
1、取培養至對數生長後期的含pBS質粒的細菌培養液250ml,4℃下5000g離心15分鐘,棄上清,將離心管倒置使上清液全部流盡。
2、將細菌沉澱重新懸浮於50ml用冰預冷的STE中(此步可省略)。
3、同步驟1方法離心以收集細菌細胞。
4、將細菌沉澱物重新懸浮於5ml溶液I中,充分懸浮菌體細胞。
5、加入12ml新配製的溶液Ⅱ,蓋緊瓶蓋,緩緩地顛倒離心管數次,以充分混勻內容物,冰浴10分鐘。6、加9ml用冰預冷的溶液Ⅲ,搖動離心管數次以混勻內容物,冰上放置15分鐘,此時應形成白色絮狀沉澱。
7、4℃下5000g離心15分鐘。
8、取上清液,加入50mlRNA酶A(10mg/ml),37℃水浴20分鐘。
9、加入等體積的飽和酚/氯仿,振盪混勻,4℃下12000g離心10分鐘。
10、取上層水相,加入等體積氯仿,振盪混勻,4℃下12000g離心10分鐘。
11、取上層水相,加入1/5體積的4mol/LNaCl和10%PEG(分子量6000),冰上放置60分鐘。
12、4℃下12000g離心15分鐘,沉澱用數ml70%冰冷乙醇洗滌,4℃下12000g離心5分鐘。
13、真空抽乾沉澱,溶於500mlTE或水中。
[注意]1.提取過程中應儘量保持低溫。2.加入溶液Ⅱ和溶液Ⅲ後操作應混和,切忌劇烈振盪。3.由於RNA酶A中常存在有DNA酶,利用RNA酶耐熱的特性,使用時應先對該酶液進行熱處理(80℃1小時),使DNA酶失活。
(二)、Wazard大量DNA純化系統
鹼法大量提取DNA往往需要很長的時間.Promega公司的Wiazrd大量DNA純化系統既簡單又快速,只需要離心和真空抽乾,這個系統可以從500ml培養液中在3小時以內獲得1mg以上的高質量的質粒DNA(200-20000bp)。該系統不需要酚和氯仿抽提,純化後的DNA溶於水或TE緩衝液中,不含任何鹽份,可以直接用於DNA序列分析和酶切反應,也可以用於在核酸酶抑制劑(如RNasin)存在的條件下進行體外轉錄反應等。該系統中含有的試劑和柱子可以用於10次100-500ml質粒培養液的分離和純化,試劑包括:150ml細胞懸浮液,150ml細胞裂解液,150ml中和液,100mlWizard大量DNA純化樹脂,125mlWizard柱子洗脫溶液和10支Wizard帶有存儲離心管的柱子。
1、100-500ml細胞培養液置離心管中,22-25℃下5000g離心10分鐘,所得細胞沉澱充分懸浮於細胞懸浮液中。
2、加15ml細胞裂解溶液並輕輕混合,可以反覆倒置混合,但不能用渦鏇振盪,細胞裂解完全時,溶液會變清,這一步需要20分鐘。
3、加15ml中和溶液,立即反覆倒置離心管數次,並使之混勻。
4、14000g,22-25℃離心15分鐘。
5、小心地將上清液吸出並移至一個新離心管中。
6、加0.5倍體積的異丙醇,混合均勻,14000g22-25℃下離心15分鐘。
7、棄上清,懸浮DNA沉澱於2mlTE緩衝液中。這一步中也許有的沉澱不能溶解。
8、加10mlWizard大量DNA純化樹脂溶液,並渦鏇混合。
9、每一個樣品,使用一支Wizard大量柱子,柱子的頭插在真空器上(Promega產品,與此配套)。
10、將樹脂/DNA混合液轉入柱子中,真空抽取樹脂/DNA混合液。
11、將樹脂/DNA混合液抽乾後,加13ml柱子洗脫溶液至離心管中,對管底部的樹脂/DNA進行洗脫(柱子一邊鏇轉一邊加入洗脫液),並加入柱子中。
12、真空抽乾所加入的洗脫。
13、再加12ml柱子洗脫液進柱子並抽乾。
14、加入5ml80%乙醇漂洗柱中的樹脂,柱子真空抽乾後將柱子放入用戶提供的離心管
中,2500rpm(1300g)離心5分鐘。
15、取出柱子,真空抽乾5分鐘,再將柱子放入系統中所提供的離心管中,2500rpm(1300g)離心5分鐘。
16、在柱子中加入1.5ml65-70℃預熱過的滅菌重蒸水或TE,1分鐘後2500rpm(1300g)離心柱子/離心管5分鐘。
17、取出柱子,離心管中溶液即為提取的質粒DNA,可以直接放在離心管中,蓋上蓋子,儲存在4℃或-20℃備用。
[注意]1.在使用之前,系統所提供的柱子洗脫液按1:1加入125ml95%乙醇。2.純化樹脂必須混勻後再用.
(三)、Sephrose2B柱純化質粒DNA
鹼法提取的質粒DNA即使用RNA酶處理,仍會含有少量RNA。當有些試驗需無RNA污染的DNA製品時,則需進行進一步純化。一般常用Sepharose2B或Sepharose4B進行純化,該方法具有快速,條件溫和,重複性好,載體物質可以再利用等優點,因而已廣泛用於質粒DNA純化。
1、將Sepharose2B經含0.1%SDS的TE(pH8.0)平衡後上柱。
2、將至多1ml的DNA溶液鋪在Sepharase2B柱上。
3、待DNA溶液完全進入柱內後立即在柱的上部連線含有0.1%SDS的TE(pH8.0)貯液瓶。
4、以1ml流出液為1份進行收集。
5、對每一管測定其OD260值,以確定哪些管中含有質粒DNA。通常質粒DNA在柱上流出的第一個峰中。
6、合併所有含質粒的洗脫液,用等體積的酚/氯仿(1:1)抽提,4℃下12000g離心2分鐘,將上層水相轉入新管。
7、加入2倍體積的冰冷無水乙醇,-20℃下沉澱10分鐘,然後4℃下12000g離心10分鐘,棄去上清液。
8、沉澱加70%乙醇洗滌,4℃下12000g離心10分鐘,棄去上清液。
9、沉澱真空抽乾,重新溶於TE或無菌水中。
[注意]在裝柱過程中,要防止柱床中出現斷裂或氣泡現象,要使界面保持平整。對新裝成的柱,套用含0.1%SDS的TE平衡,以使柱內的凝膠均勻。
複製特性
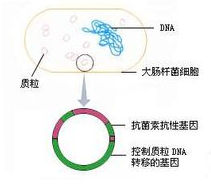
質粒是真核細胞細胞核外或原核生物擬核區外能夠進行自主複製的遺傳單位,包括真核生物的細胞器(主要指線粒體和葉綠體)中和細菌細胞擬核區以外的環狀脫氧核糖核酸(DNA)分子。現在習慣上用來專指細菌(大腸桿菌)、酵母菌和放線菌等生物中細胞核或擬核中的DNA以外的DNA分子。在基因工程中質粒常被用做基因的載體(Vector)。許多細菌除了擬核中的DNA外,還有大量很小的環狀DNA分子,這就是質粒(plasmid)(補充:部分質粒為RNA)。質粒上常有抗生素的抗性基因,例如,四環素抗性基因或卡那黴素抗性基因等。有些質粒稱為附加體(episome),這類質粒能夠整合進真菌的染色體,也能從整合位置上切離下來成為游離於染色體外的DNA分子。質粒在宿主細胞體內外都可複製!目前,已發現有質粒的細菌有幾百種,已知的絕大多數的細菌質粒都是閉合環狀DNA分子(簡稱cccDNA)。細菌質粒的相對分子質量一般較小,約為細菌染色體的0.5%~3%。根據相對分子質量的大小,大致上可以把質粒分成大小兩類:較大一類的相對分子質量是40×106以上,較小一類的相對分子質量是10×106以下(少數質粒的相對分子質量介於兩者之間)。每個細胞中的質粒數主要決定於質粒本身的複製特性。按照複製性質,可以把質粒分為兩類:一類是嚴緊型質粒,當細胞染色體複製一次時,質粒也複製一次,每個細胞內只有1~2個質粒;另一類是鬆弛型質粒,當染色體複製停止後仍然能繼續複製,每一個細胞內一般有20個左右質粒。這些質粒的複製是在寄主細胞的鬆弛控制之下的,每個細胞中含有10-200份拷貝,如果用一定的藥物處理抑制寄主蛋白質的合成還會使質粒拷貝數增至幾千份。如較早的質粒pBR322即屬於鬆弛型質粒,要經過氯黴素處理才能達到更高拷貝數。一般分子量較大的質粒屬嚴緊型。分子量較小的質粒屬鬆弛型。質粒的複製有時和它們的宿主細胞有關,某些質粒在大腸桿菌內的複製屬嚴緊型,而在變形桿菌內則屬鬆弛型。
培養
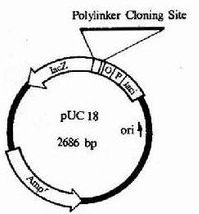
在基因工程中,常用人工構建的質粒作為載體。人工構建的質粒可以集多種有用的特徵於一體,如含多種單一酶切位點、抗生素耐藥性等。常用的人工質粒運載體有pBR322、pSC101。pBR322含有抗四環素基因(Tcr)和抗氨苄青黴素基因(Apr),並含有27種限制性內切酶的單一識別位點。如果將DNA片段插入EcoRI切點,不會影響兩個抗生素基因的表達。但是如果將DNA片段插入到HindⅢ、BamHI或SalI切點,就會使抗四環素基因失活。這時,含有DNA插入片段的pBR322將使宿主細菌抗氨苄青黴素,但對四環素敏感。沒有DNA插入片段的pBR322會使宿主細菌既抗氨苄青黴素又抗四環素,而沒有pBR322質粒的細菌將對氨苄青黴素和四環素都敏感。pSC101與pBR322相似,只是沒有抗氨苄青黴素基因和PstI切點。質粒運載體的最大插入片段約為10kb(kb表示為千鹼基對)。1973年,科學家將質粒作為基因的載體使用,為基因工程的誕生奠定了基礎。
最常用的質粒是大腸桿菌的質粒。這種質粒常含有抗生素抗性基因,例如,卡那黴素抗性基因。
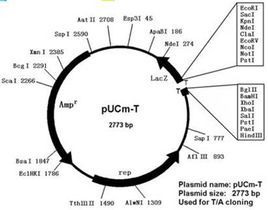
pBR322質粒
pBR322質粒DNA分子的長度為4361bp*(*SequencingdatafromWatson(confirmedatNewEnglandBiolabs,Inc.)hasshownpBR322tobe4,361basepairs,not4,363basepairsaspreviouslyreported.)[3],此載體中有兩個標記基因,一個是氨苄青黴素抗性基因(Apr),另一個是四環素抗性基因(Tetr)。現在已知pBR322DNA分子共有24種核酸內切限制酶的單一識別位點。其中7種限制酶(從12:00位置按順時針方向)即EcoRV、NheI、BamHI、SphI、SalI、XmaⅢ和NruI的識別位點位於四環素抗性基因內部,另外有2種限制酶即ClaI和HindⅢ的識別位點是存在於這個基因的啟動區內,在這9個限制位點上插入外源DNA都會導致tetr的失活。3種限制酶即ScaI、PvuI和PstI的識別位點位於氨苄青黴素抗性基因內,在這些位點插入外源DNA則會導致ampr基因的失活。由pBR322質粒載體的結構可知其具有如下優點:⑴具有較小的分子量。經驗表明,為了避免在DNA的純化過程中發生鏈的斷裂,克隆載體的分子大小最好不要超過10Kb。pBR322質粒這種小分子量的特點,不僅易於自身DNA的純化,而且可容納較大的外源DNA片段;⑵具有兩種抗菌素抗性基因可供作轉化子的選擇記號,能指示載體或重組DNA分子是否進入宿主細胞以及外源DNA分子是否插入載體分子形成了重組子。標記基因往往可以賦予宿主細胞一種新的表型,這種轉化細胞可明顯地區別於非轉化細胞。當我們把一個DNA片段插入到某一個標記基因內時,該基因就失去了相應的功能。當把這種重組DNA分子轉到宿主細胞後,該基因原來賦予的表型也就消失了。要是仍保留了原來表型的轉化細胞,細胞內含有的DNA分子一定不是重組子。很顯然,既要指示外源DNA是否進入了宿主細胞,又要指示載體DNA分子中是否插入了外源DNA片段,那么這種載體必須至少具有兩個標記基因。另外,pBR322質粒載體還具較高的拷貝數,而且經過氯黴素擴增之後,每個細胞中可積累1000~3000個拷貝,這就為重組體DNA的製備提供了極大的方便。
載體構建
pBR322質粒載體的構建過程可簡單地概括如下:1、由於pBR322質粒的親本之一是pMB1質粒,故首先以pMB1為基礎,引入Rldrd19質粒的Tn3易位子,得到13.3kb的pMB3質粒;
2、pMB3的分子量顯然使得它不適合作為載體,所以要通過在EcoRI活性條件下的消化讓它大部分的無用片段失去,留下來的小片段的DNA的黏性末端連線起來後就形成了pMB8質粒(2.6kb);
3、此時,另外一種pSC101質粒在EcoRI活性條件下消化產生了含有tetr抗性的DNA片斷,這個片斷和pMB8整合在一起就形成了pMB9質粒(5.3kb)。此時pMB9為ampstetr表型;
4、pMB9已經初步具備載體的功能,為了讓它更加完善,我們要讓它具備amprtetr性能,即在pMB9上引入pSF2124的Tn3易位子,但Tn3可以來也可以走,為了留住它,我們切去了Tn3中表達轉位酶的基因,形成了pBR313質粒。
此後我們兵分兩路:一路把pBR313的PstI位點除去,使之成為ampstetr表型的pBR318質粒;
5、;另一路把pBR313的EcoRⅡ的位點切除,使之成為amprtets表形的pBR320質粒。
由此我們的到了兩種功能互補的質粒,這樣我們只要將他們雜交就可以得到一種接近全能的載體質粒了,這就是pBR322。
套用技術
了解了pBR322的結構和它的構建過程之後,我們來看pBR322在基因工程中的套用。pBR322質粒作為一種常用的基因克隆載體,在實際套用中有著非常重要的地位,其中一個突出的例子就是套用pBR322作為克隆載體對水稻的葉綠體光誘導基因psbA進行結構分析。
將水稻葉綠體的DNA,用EcoRI核酸限制性內切酶消化之後,放入含有溴化乙錠的低熔點(LMP)的1%瓊脂糖凝膠中作電泳分離。從LMP中分離出分子大小為1.8~2.5kb之間的DNA片段,再與同樣經過了EcoRI核酸限制性內切酶切割並用鹼性磷酸酶作了脫磷酸處理的pBR322質粒連線。然後,將混合物轉化到大腸桿菌5346菌株,培養在氨苄青黴素選擇平板上,形成Ampr轉化子菌落群體。這樣就構成了由EcoRI核酸限制性內切酶切割的水稻葉綠體DNA基因組庫。用Ampr轉化子菌落與32P放射性標記的玉米psbADNA探針作菌落雜交,可以分離出其中的陽性克隆體。從這些陽性克隆體中分離出來的重組體質粒DNA,經過進一步的分析,就能測出水稻葉綠體基因psbA的序列。
利用pBR322作為載體重組人體的抑生長激素也是一個經常提到的套用例子。其過程和水稻葉綠體基因重組大同小異,只是除了在質粒載體上插入抑生長激素基因外,還將含有lac操縱子起始部分的片段(包括啟動子、操縱區、核糖體結合位點和β-半乳糖苷酶的主要部分)插在抑生長激素基因的旁邊。由於有了lac操縱子的控制,重組基因產生的蛋白質的調節就變得比較容易了。