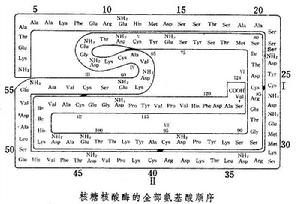
蛋白質順序分析
測定蛋白質多肽鏈的胺基酸排列順序,又稱蛋白質的一級結構分析。
測定方法一般需要以下的技術和步驟:蛋白質的純化,測定分子量,分析輔基或配基,胺基酸定量組成分析,末端分析,拆開二硫鍵,肽的裂解、純化及順序測定,尋找接頭肽以連線成完整的肽鏈,再經過二硫鍵定位,最後列出完整蛋白質的順序。
蛋白質的純化 待測定順序的蛋白質樣品,需要較高的純度。須通過多種方法鑑定,如末端分析、電泳、等電聚焦、胺基酸定量組成分析等都證明是均一的蛋白質,雜質含量在5%以下,才適於做順序分析。
測定分子量 一般用凝膠過濾法,十二烷基硫酸鈉聚丙烯醯胺凝膠電泳法。從兩種數據,還可知道樣品蛋白質是否有亞基結構。
輔基和配基分析 簡單蛋白質不含輔基和配基。但結合蛋白質含糖、核酸、脂質或其他有機化合物,這些物質會干擾順序分析,需採用特殊方法除去。
胺基酸定量組成分析 用胺基酸自動分析儀能準確測定蛋白質樣品中各種胺基酸的含量,特別是某些胺基酸,如甲硫氨酸、色氨酸、精氨酸和賴氨酸等的含量對設計順序測定方案很重要。
末端分析 多肽鏈的一端為NH2,稱為N端,另一端為COOH,稱為C端。N端測定用FDNB(2,4-二硝基氟苯),DNS-Cl (1-二甲基萘胺-5-磺醯氯)和DABITC(4-NN’二甲基-胺重氮苯-4’-異硫氰酸酯) 等化學試劑測定。也可用氨肽酶法。C 端用肼解法或羧肽酶法測定。有的蛋白質的N末端被其他化學基團,如乙醯基,或環化谷氨酸所封閉,就不能用上述方法測定。通過末端分析也能了解蛋白質由幾條肽鏈組成和樣品的純度。
拆開二硫鍵 肽鏈中的半胱氨酸殘基,常以二硫鍵的方式與肽鏈中的其他部位半胱氨酸殘基連線,測定順序時須先拆開二硫鍵,使肽鏈呈鬆散的直鏈,便於降解和裂解。拆開方法是用巰基試劑還原羧甲基化,或用過甲酸氧化等。
肽的裂解和純化 先將蛋白質裂解成較大的肽段,以減少純化和順序測定的工作量。在一般蛋白質分子中,甲硫氨酸、色氨酸和精氨酸等含量較少,可用專一性高的試劑或酶針對這類胺基酸的肽鍵裂解,如用溴化氰,氫溴酸和胰蛋白酶等,能得到預期的結果。肽的純化,一般用離子交換層析,凝膠過濾,電泳和紙層析等方法。70年代以來採用高效液相層析儀,其解析度高,速度快,是純化肽的最好工具。
肽的順序測定 ①埃德曼降解法。用化學試劑──異硫氰酸苯酯,能依次從N端逐個把胺基酸殘基降解下來。每一步反應得到一個胺基酸衍生物。經多次重複的反應就得到更多的降解產物,分別鑑定後,即可列出肽鏈的胺基酸順序。根據這個原理設計的自動順序儀,一晝夜連續運轉,可測出10多個順序。但由於化學反應率的限制,不可能無限制地降解到底,因為即使在最好的條件下,每步反應率到98%,一般只能測到50步左右,這時留下的可供反應的N端愈來愈少,雜質愈來愈多,難以繼續測定。所以通常需先把肽鏈裂解成肽段後再測其順序。②酶法測順序。用氨肽酶能從N端依次降解,用羧肽酶能從C端依次降解。酶解釋放胺基酸是個動力學過程,需在不同時間取樣定量測定,根據釋放的過程列出順序,由於酶解過程難以控制,此法得到的數據,一般僅為幾個胺基酸順序。
接頭肽 在完成許多肽段的順序測定後,需要尋找接頭肽以把各肽段連線起來而完成蛋白質的全部順序。其連線法如圖所示。用一個字母表示一個胺基酸殘基:
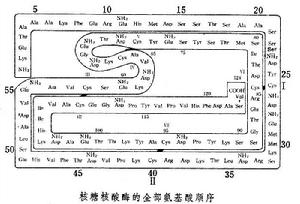 蛋白質順序分析
蛋白質順序分析第1種切法 ABCDEFG HIKLMNOP QRSTVWXYZ
第2種切法 FGHIKOPQRS
完整的肽鏈 ABCDEFGHIKLMNOPQRSTVWXYZ
二硫鍵定位 用專一性低的蛋白水解酶,如胃蛋白酶、嗜熱菌蛋白酶等水解完整的蛋白質成為小的肽段,經分離純化,找尋含二硫鍵的肽段。亞硝基鐵氰化鈉是二硫鍵的特殊顯色劑。測定這些肽段的胺基酸組成和順序,即可確定肽鏈內部二硫鍵的位置,得到完整的蛋白質的胺基酸順序。
上面介紹的經典的蛋白質順序測定法,是非常繁瑣而工作量浩大的工作。50年代初測定含51個胺基酸殘基的胰島素花了8年時間,現在用自動化儀器和先進檢測工具,只需花一周時間。1978年發表的β-半乳糖苷酶,含1021個胺基酸殘基,可以說是經典法測定的頂峰。目前新的快速方法是從核酸(DNA)順序推測蛋白質順序,已經廣泛採用,因在短期內可測數千個核苷酸順序,從DNA的三聯密碼能準確推測出蛋白質的胺基酸順序。這一方法近年來已經有取代上述經典方法的趨勢,但是儘管如此,某些環節還須蛋白質順序測定的經典法配合。