病因
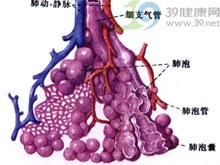 肺泡蛋白質沉積症
肺泡蛋白質沉積症雖然啟動因素尚不明確,但基本上同意發病過程為脂質代謝障礙所致。即由於機體內、外因素作用引起肺泡表面活性物質的代謝異常。到目前為止,研究較多的有肺泡巨噬細胞活力,動物實驗證明巨噬細胞吞噬粉塵後其活力明顯下降,而病員灌洗液中的巨噬細胞內顆粒可使正常細胞活力下降,經支氣管肺泡灌洗治療後,其肺泡巨噬細胞活力可上升。而研究未發現Ⅱ型細胞生成蛋白增加,全身脂代謝也無異常。因此目前一般認為本病與清除能力下降有關。
病理
 肺泡蛋白質沉積症
肺泡蛋白質沉積症臨床表現
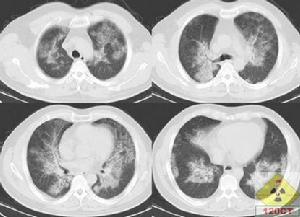 肺泡蛋白質沉積症
肺泡蛋白質沉積症胸部X線表現為從兩側肺門向外放散的彌散性邊緣模糊細小結節陰影,常融合成片狀,病灶之間有代償性氣腫或形成小透亮區。
流行病學
PAP是一類罕見的疾病,美國賓夕法尼亞州報導年發病率為每百萬人群0.2。90%PAP是原發性病例,男性患病約為女性的3倍,各年齡組均可發病,30~50歲是患病高峰。吸菸與PAP的發病密切相關,72%患者有吸菸史。發病機制
近年來,有關原發性PAP發病機制的研究使我們對這組疾病的本質有了新的認識。發病機制
動物模型和人類資料顯示,GM-CSF在原發性PAP的發病機制中起著重要作用。體外研究發現,GM-CSF對血液系統的中性粒細胞和單核/巨噬細胞的增殖和分化具有很強的刺激作用。外源性的重組GM-CSF能夠刺激骨髓造血,使外周血中性粒細胞,單核細胞和嗜酸粒細胞增多。肺泡表面活性物質主要由Ⅱ型肺泡上皮細胞合成、儲存和分泌,再由Ⅱ型肺泡上皮細胞和肺泡巨噬細胞攝取、降解和再利用,正常情況下這一過程保持動態平衡。其中GM-CSF是激活肺泡巨噬細胞清除肺泡表面活性物質所必需的。採用基因定向技術使小鼠GM-CSF編碼基因缺失(GM-/-)或GM-CSF受體缺乏(bc-/-),這些動物的造血功能沒有異常,而肺泡巨噬細胞清除肺泡表面活性物質的功能發生障礙,導致小鼠肺泡蛋白沉積,其組織病理學特徵類似人類PAP。通過轉基因技術在呼吸上皮細胞重建GM-CSF的表達,能夠使GM-/-小鼠肺泡內沉積的磷脂蛋白樣物質消失。類似地,骨髓移植或霧化吸入GM-CSF也對GM-/-小鼠的肺泡蛋白沉積有治療作用。
原發性PAP患者的血液和BAL中可以檢測到高水平的抗GM-CSF中和性抗體,這些中和性抗體阻斷了GM-CSF的生物活性,使內源性GM-CSF水平相對減低,致使巨噬細胞對肺泡表面活性物質的清除和再利用能力降低。吞噬了過量磷脂的巨噬細胞還表現出其它方面的功能障礙,如運動能力降低,吸附和化學趨化能力缺陷以及吞噬細菌的能力下降。由於存在肺泡巨噬細胞的功能缺陷,GM-/-小鼠或PAP患者容易並發感染。
PAP患者巨噬細胞的胞漿呈泡沫樣改變並充滿脂質物,過氧化物酶增殖物激活受體(PPAR)g,及其調節的ATP結合體脂質轉運體(ABCG1)轉錄因子的表達顯著降低。利妥昔單抗(美羅華)是嵌合小鼠的人類單克隆抗體,能夠對抗B淋巴細胞特異性抗原CD20。利妥昔單抗通過刺激肺泡巨噬細胞ABCG1和溶酶體磷脂(LPL)A2的活性,能夠增加脂肪的轉運和表面活性物質的代謝。
GM-CSF如何調節巨噬細胞的成熟和功能?最近的研究發現,GM-CSF通過誘導PU.1的表達來調節肺泡巨噬細胞終末期的分化,轉錄因子PU.1是ets家族的成員,具有調節骨髓單核細胞和B淋巴細胞的成熟和分化的作用。GM-/-小鼠PU.1轉錄因子的表達降低,相應地,巨噬細胞的成熟、分化以及肺泡表面活性物質的代謝也減低。當GM-CSF缺乏得到糾正後,PU.1的表達增強,PU.1依賴性標誌物如CD32,甘露糖受體和巨噬細胞克隆刺激因子受體的水平也上調。類似地,PAP患者BALF中細胞PU.1mRNA的表達比健康人顯著地降低。外源性GM-CSF治療後,PAP患者肺泡巨噬細胞PU.1基因水平顯著上調。體外試驗進一步證實,將PU.1基因轉染到GM-/-小鼠的巨噬細胞後,巨噬細胞的異常包括肺泡表面活性物質的代謝異常能夠得到有效的恢復
診斷
主要根據支氣管肺泡灌洗物檢查或經纖支鏡或剖胸活檢作出病理診斷。咳出的痰經80%乙醇固定,PAS染色有15%陽性的脂質。治療
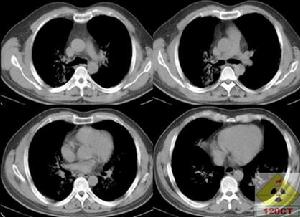 肺泡蛋白質沉積症
肺泡蛋白質沉積症肺泡蛋白沉著症(Pulmonary alveolar proteinosis,PAP)是一少見呼吸病,以肺泡及終末呼吸性細支氣管內沉著大量的表面活性蛋白及脂質為特徵。根據發病,可將其分為原發性PAP 與繼發性PAP兩類。繼發性PAP的治療原則為治療原發病。
對於原發PAP,明確有效的治療方法是支氣管肺泡灌洗,即通過灌洗清除肺泡內沉著的蛋白質和脂質。其效果取決於肺灌洗量,分次單側全肺盥洗較纖支鏡盥洗效果好。然而,當患者肺功能嚴重損害時則無法接受這一治療方法。其原因是盥洗一側肺內很少有可交換的氣體,結果引起低氧血症甚至呼吸衰竭。雖然可選擇體外循環或在高壓氧艙進行全肺灌洗,但會增加費用和併發症,也不便於操作。此外,灌注結束時肺內殘留的液體可達0.5-1.0升,需2-3天才能吸收乾淨,也會影響患者呼吸功能。
為克服這些不足,自1999年始試用了自己改良的全麻密閉加壓給氧分側肺盥洗術,與以往方法的差別是新方法中有2個重要的改良:1、肺盥洗時給予密閉加壓給氧。向肺內灌注生理鹽水至單側肺總量後,手動擠壓給氧同時保持呼氣末正壓5厘米水柱,使其中純氧和肺泡內盥洗液充分混合30-60次後再回收盥洗液。2、在首次和結束前的兩次盥洗液中,均在生理鹽水盥洗液中加入腎上腺素(1mg/L)。
第一個改良有三個有益作用:(1)使盥洗液與肺泡充分接觸,增加盥洗效果;(2)改善氧合功能,特別適合單側肺通氣不能保持氧分壓在安全範圍者。因為它可以使純氧混合在液體中,充分與肺泡接觸而增加氧合。如果術中氧飽和度降低,除調整非盥洗肺的吸氧濃度和呼吸支持參數外,還應增加盥洗肺側的給氧擠壓時間。(3)在盥洗肺側加壓給氧的同時,可由於肺泡內壓的升高而減少分流量和改善動脈血氧分壓。第二個改良的有益作用是在生理鹽水盥洗液中加入腎上腺素後,不但有利於舒張支氣管和回收盥洗液;而且有利於吸收肺泡內殘留液體,減少其對呼吸功能的影響。
目前新方法已經套用到少數的患者,均取得了明顯的效果。
疾病症狀
起病隱匿,患者相對輕微的症狀與嚴重的影像學表現或肺功能障礙往往不相符合。臨床症狀變異性大,通常是非特異性的,多數表現為漸進性勞力性呼吸困難(80%)和咳嗽(60%)。少數患者出現消瘦、乏力、胸痛和咯血(20%)。部分患者甚至沒有症狀。發熱常提示合併感染。體格檢查通常正常或肺部沒有特異性的體徵,25%的患者有紫紺,半數可聞及吸氣性爆裂音,杵狀指少見。輔助檢查
影像學表現
典型的胸片表現是雙肺對稱的肺泡填充性陰影,肺門旁的浸潤陰影延伸至外帶,呈“蝴蝶狀”分布,雙肋膈角往往不受累及。可是多數的PAP病例報導PAP的胸片沒有上述典型的特徵,因此X線胸片的表現通常不具有特異性。胸部HRCT能清晰地顯示肺部受累的範圍和特點。磨玻璃影與正常肺臟分界明顯,呈“地圖”樣分布;小葉內和小葉間隔增厚,呈多角形,稱為“鋪路石征”;或者表現為大片的實變影伴支氣管充氣征,周圍環繞著磨玻璃影。極少數病例有肺間質纖維化的表現,往往是疾病晚期。這些病變的程度和範圍與肺功能以及肺臟氣體交換障礙密切相關。
肺功能和血氣分析
限制性通氣功能障礙和彌散障礙最為常見,沒有顯著的氣流受限。病變早期,部分患者的肺功能正常。1/3的患者在靜息狀態下和超過半數患者在運動時,出現低氧血症和肺泡-動脈氧分壓差增大,這主要是通氣血流比例失調和肺內分流率增加所致。
支氣管肺泡灌洗液
支氣管肺泡灌洗液具有特徵性的表現。外觀呈乳狀渾濁液體,靜置後沉澱分層。光鏡下可見非細胞性的圓形小體,姬姆薩染色呈嗜鹼性,PAS染色陽性;背景顯得“很髒”,可見大量的細胞碎屑,PAS染色陽性;巨噬細胞呈泡沫樣改變,胞漿內可見PAS陽性包涵體。淋巴細胞和漿細胞比例增高。電鏡下可見特徵性的髓樣多層狀結構和層狀小體,其成分是磷脂。
生物學標誌物
80%PAP患者血清和支氣管肺泡灌洗液乳酸脫氫酶水平輕度增高,全肺灌洗或自發性緩解後,乳酸脫氫酶水平能夠恢復正常。血清乳酸脫氫酶水平與PaO2或肺泡-動脈氧分壓差成顯著地正相關,可以作為衡量疾病嚴重程度的指標。肺泡上皮細胞產生的其他蛋白產物,如癌胚抗原,細胞角蛋白19,KL-6以及肺泡表面活性物質A,B,D的血清水平也增高。PAP患者BAL中天冬氨酸肽酶A和組織蛋白酶H的水平和活性也顯著增高,這些指標的意義還有待進一步研究。
抗GM-CSF抗體
原發性PAP患者血液和BAL中都能檢測到抗GM-CSF抗體,而先天性或繼發性PAP患者中不能檢測到抗GM-CSF抗體,健康人群中只有0.3%(4/1258)呈陽性。血液和BAL中抗GM-CSF抗體陽性對診斷PAP具有高度的敏感性(92%~100%)和特異性(98%~100%),可以作為診斷原發性PAP的重要依據。處於疾病活動期需要治療的患者,血清或BAL抗GM-CSF抗體滴度顯著地高於自發緩解的患者,抗GM-CSF抗體也可以作為監測疾病活動性的指標。BAL中抗GM-CSF抗體的水平與血清乳酸脫氫酶,PaO2,肺泡-動脈氧分壓差,肺臟一氧化碳彌散量,胸片或胸部HRCT評分等顯示疾病嚴重程度的指標密切相關,可以反映疾病的嚴重程度,對是否採取全肺灌洗治療有重要的提示作用。
