細胞周期調控cellcycleregulation;
圖書信息
書 名: 細胞周期調控原理
作者:D.O.摩爾根(Morgan.D.O.)
開本: 16開
定價: 75.00元
概述
細胞是有機體的基本結構單位和功能單位,而細胞周期則是保證細胞進行生命活動的基本過程。細胞周期分為:合成DNA的時期稱為DNA合成期(S期),進行DNA拷貝分配和細胞分裂的時期稱為有絲分裂期(M期),在M期結束後和S期開始前的一段間隙稱為G1期,而在S期結束後和M期開始前的間隙則稱為G2期。真核細胞內有一個調控機構,使細胞周期能有條不紊地依次進行。細胞周期的準確調控對生物的生存、繁殖、發育和遺傳均是十分重要的,細胞周期各時相中有各自特異性的細胞周期蛋白控制細胞周期有序地進行。
細胞周期
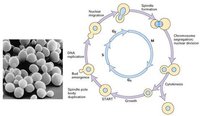
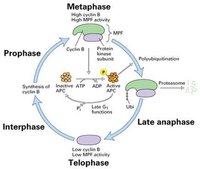
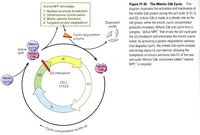 細胞周期運轉總圖
細胞周期運轉總圖何為細胞周期?細胞的生命開始於產生它的母細胞的分裂, 結束於它的子細胞的形成,或是細胞的自身死亡。通常將通過細胞分裂產生的新細胞的生長開始到下一次細胞分裂形成子細胞結束為止所經歷的過程稱為細胞周期。在這一過程中,細胞的遺傳物質複製並均等地分配給兩個子細胞。細胞周期(cell cycle)是指細胞從第一次分裂結束產生新細胞到第二次分裂結束所經歷的全過程,分為間期與分裂期兩個階段。
(一)間期
(二)分裂期
作者簡介
作者:(英國)D.O.摩爾根(Morgan.D.O.) 譯者:李朝軍 潘飛燕 戴谷 等
圖書目錄
前言
致謝
本書使用說明
第一章 細胞周期
1-0節 概述:細胞複製
1-1節 真核細胞周期事件
1-2節 細胞周期組織形式的差異
1-3節 細胞周期調控系統
第二章 分析細胞周期的模式生物
2-0節 概述:不同真核生物的細胞周期分析
2-1節 釀酒和裂殖酵母的生活周期
2-2節 酵母中細胞周期調控的遺傳分析
2-3節 非洲爪蟾的早期胚胎
2-4節 黑腹果蠅
2-5節 哺乳動物的細胞周期分析
2-6節 細胞周期分析方法
第三章 細胞周期調控系統
3-0節 概述:細胞周期調控系統
3-1節 細胞周期蛋白依賴激酶
3-2節 細胞周期蛋白
3-3節 Cdk活性受磷酸化控制
3-4節 Cdk激活的結構基礎
3-5節 周期蛋白-Cdk複合物的靶向底物
3-6節 抑制性亞單位對Cdk的調節
3-7節 信號系統中的生化開關
3-8節 Cdk工的開關樣激活
3-9節 細胞周期控制中的蛋白降解
3-10節 後期啟動複合物
3-11節 細胞周期振盪器的裝配與調節
3-12節 細胞周期調節物的轉錄控制
3-13節 細胞周期調控系統的編程
第四章 染色體複製
4-0節 概述:染色體複製及其調控
4-1節 DNA合成的基本機制
4-2節 複製起始位點
4-3節 前複製複合物在複製起始位點的裝配
4-4節 前複製複合物的調節
4-5節 酵母中複製起始位點激活需要的周期蛋白
4-6節 後生動物中複製起始位點激活需要的周期蛋白
4-7節 蛋白激酶Cdc7-Dbf4對複製的調控
4-8節 複製起始位點的激活
4-9節 染色質的基本結構
4-10節 S期組蛋白的合成
4-11節 新生DNA上核小體的裝配
4-12節 端粒和著絲粒處的異染色質
4-13節 異染色質複製的分子機制
第五章 有絲分裂前半段:為染色體分隔做準備
5-0節 概述:有絲分裂事件
5-1節 概述:有絲分裂調控的原則
5-2節 酵母中啟動有絲分裂進入的周期蛋白
5-3節 後生動物中啟動有絲分裂進入的周期蛋白
5-4節 Weel和Cdc25對有絲分裂Cdks的調控
5-5節 有絲分裂期周期蛋白B-Cdkl的開關樣激活
5-6節 有絲分裂調節因子的亞細胞定位
5-7節 Polo和Aurora蛋白激酶家族
5-8節 有絲分裂的準備:姊妹染色單體的黏合
5-9節 有絲分裂的進入:姊妹染色單體壓縮和解散
5-10節 染色體壓縮和解散的調控
第六章 有絲分裂紡錘體的組裝
6-0節 概述:有絲分裂紡錘體
6-1節 微管的結構及行為
6-2節 微管的核化,穩定性和運動性
6-3節 中心體和紡錘體極體
6-4節 中心體複製的控制
6-5節 動粒
6-6節 紡錘體組裝的早期步驟
6-7節 核被膜破裂
6-8節 有絲分裂染色體在紡錘體組裝中的功能
6-9節 姊妹染色單體對紡錘體的附著
6-10節 姊妹染色單體的雙指向性
6-11節 驅動染色體移動的力量
6-12節 染色體中板集合
第七章 有絲分裂的完成
7-0節 概述:有絲分裂的完成
7-1節 後期的啟動:APC的激活
7-2節 後期的啟動:紡錘體檢驗點
7-3節 紡錘體檢驗點對ApC的抑制
7-4節 姊妹染色單體分離的調控
7-5節 釀酒酵母有絲分裂的後半段調控
7-6節 後期事件的調控
7-7節 末期的調控
第八章 胞質分裂
8-0節 概述:胞質分裂
8-1節 肌動蛋白-肌球蛋白環
8-2節 肌動蛋白-肌球蛋白收縮環的組裝和收縮
8-3節 分裂部位的細胞膜和細胞壁沉積
8-4節 酵母細胞胞質分裂的位置和時間決定
8-5節 動物細胞胞質分裂的位置和時間決定
8-6節 動物發育過程中胞質分裂的特殊性
8-7節不對稱分裂
第九章 減數分裂
9-0節 概述:減數分裂
9-1節 酵母細胞減數分裂的早期事件的調控
9-2節 減數分裂的同源重組
9-3節 減數分裂前期的同源配對
9-4節 減數分裂前期的晚期交叉的形成
9-5節 第一次減數分裂進入的控制
9-6節 減數分裂Ⅰ染色體的附著
9-7節 減數分裂Ⅰ染色體的分離
9-8節 減數分裂的完成
第十章 細胞增殖和生長的調控
10-0節 概述:細胞增殖和生長的調控
10-1節 釀酒酵母Stan點基因表達的激活
10-2節 釀酒酵母S-Cdks的激活
10-3節 酵母Stan點的細胞外調控:交配因子信號
10-4節 動物細胞Stan檢驗點基因表達的激活
10-5節 E2F-pRB複合物的調節
10-6節 動物細胞的有絲分裂原信號
10-7節 有絲分裂原激活G1-CdKs
10-8節 動物細胞G1/S-和S-Cdk複合物的激活
10-9節 細胞增殖的發育調控
10-10節 概述:細胞分裂和細胞生長的協調
10-11節 細胞生長的調控
10-12節 酵母細胞生長和細胞分裂的協調
10-13節 動物細胞生長和細胞分裂的協調
10-14節 細胞死亡的調控
第十一章 DNA損傷反應
11-0節 概述:DNA損傷反應
11-1節 DNA損傷的探測和修復
11-2節 DNA損傷反應:招募ATR和ATM
11-3節 DNA損傷反應:接頭蛋白和Chk1及Chk2
11-4節 DNA損傷引起的p53的激活
11-5節 DNA損傷對起始點轉換進程的影響
11-6節 DNA損傷在複製叉處的影響
11-7節 DNA損傷對DNA合成和有絲分裂的影響
11-8節 對有絲分裂原與端粒壓力的反應
第十二章 腫瘤的細胞周期
12-0節 概述:腫瘤細胞周期的缺陷
12-1節 基因突變啟動腫瘤形成
12-2節 癌症的組織特異性
12-3節 腫瘤細胞進入細胞周期的刺激因素
12-4節 腫瘤中細胞的生長和存活
12-5節 癌症的遺傳不穩定性
12-6節 端粒和染色體結構的不穩定性
12-7節 染色體數目的不穩定性
12-8節 癌症的進程
12-9節 遏制癌症
參考文獻
辭彙表
索引
細胞周期調控的研究背景
Rao和Johnson(1970、1972、1974)將Hela細胞同步於不同階段,然後與M期細胞混合,在滅活仙台病毒介導下,誘導細胞融合,發現與M期細胞融合的間期細胞產生了形態各異的早熟凝集染色體(prematurely condensed chromosome,PCC),這種現象叫做早熟染色體凝集(premature chromosome condensation)。
G1期PCC為單線狀,因DNA未複製。
S期PCC為粉末狀,因DNA由多個部位開始複製。
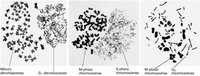 不同形態的PCC
不同形態的PCCG2期PCC為雙線染色體,說明DNA複製已完成。
不僅同類M期細胞可以誘導PCC,不同類的M期細胞也可以誘導PCC產生,如人和蟾蜍的細胞融合時同樣有這種效果,這就意味著M期細胞具有某種促進間期細胞進行分裂的因子,即成熟促進因子(maturation promoting factor,MPF)。
早在1960s,Yoshio Masui發現成熟蛙卵的提取物能促進未成熟卵的胚胞破裂(Germinal Vesicle Breakdown,GVBD),後來Sunkara將不同時期Hela細胞的提取液注射到蛙卵母細胞中,發現G1和S期的抽取物不能誘導GVBD,而G2和M期的則具有促進胚胞破裂的功能,它將這種誘導物質稱為有絲分裂因子(MF)。後來在CHO細胞,酵母和粘菌中也提取出相同性質的MF。這類物質被統稱為MPF。
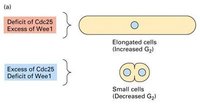 細胞周期調控
細胞周期調控1960s Leland Hartwell以芽殖酵母
為實驗材料,利用阻斷在不同細胞周期階段的溫度敏感突變株(在適宜的溫度下和野生型一樣),分離出了幾十個與細胞分裂有關的基因(cell division cycle gene,CDC)。如芽殖酵母的cdc28基因,在G2/M轉換點發揮重要的功能。Hartwell還通過研究酵母菌細胞對放射線的感受性,提出了checkpoint(細胞周期檢驗點)的概念,意指當DNA受到損傷時,細胞周期會停下來。
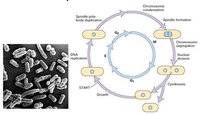 裂殖酵母細胞周期
裂殖酵母細胞周期1970s Paul Nurse等人以裂殖酵母為實驗材料,同樣發現了許多細胞周期調控基因,如:裂殖酵母cdc2、cdc25的突變型和在限制的溫度下無法分裂;wee1突變型則提早分裂,而cdc25和wee1都發生突變的個體卻會正常地分裂。進一步的研究發現cdc2和cdc28都編碼一個34KD的蛋白激酶,促進細胞周期的進行。而weel和cdc25分別表現為抑制和促進CDC2的活性。這也解釋了為何cdc25和wee1雙重突變的個體可以恢復野生型的表型。
 芽殖酵母細胞周期
芽殖酵母細胞周期 細胞周期調控
細胞周期調控1983年Timothy Hunt首次發現海膽卵受精後,在其卵裂過程中兩種蛋白質的含量隨細胞周期劇烈振盪,在每一輪間期開始合成,G2/M時達到高峰,M結束後突然消失,下輪間期又重新合成,故命名為周期蛋白(cyclin)。後來在青蛙、爪蟾、海膽、果蠅和酵母中均發現類似的情況,各類動物來源的細胞周期蛋白mRNA均能誘導蛙卵的成熟。用海洋無脊椎動物和兩棲類的卵為實驗材料進行這類實驗,好處在於卵的量比較大,而且在胚胎髮育的早期,細胞分裂是同步化的。
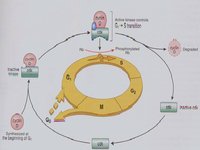
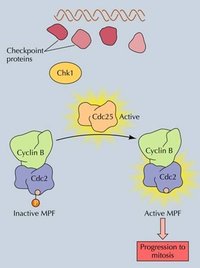 MPF=CDC2+Cyclin B
MPF=CDC2+Cyclin B1988年M. J. Lohka 純化了爪蟾的MPF,經鑑定由32KD和45KD兩種蛋白組成,二者結合可使多種蛋白質磷酸化(圖13-19)。後來Paul Nurse(1990)進一步的實驗證明P32實際上是CDC2的同源物,而P45是cyclinB的同源物,從而將細胞周期三個領域的研究聯繫在一起。
細胞周期的“分子引擎”
M期促進因子
在結構上,它是一種複合物,由周期蛋白依賴性蛋白激酶(Cdk)和G2期周期蛋白組成,其中,周期蛋白對蛋白激酶起激活作用,周期蛋白依賴性蛋白激酶是催化亞基, 它能夠將磷酸基團從ATP轉移到特定底物的絲氨酸和蘇氨酸殘基上。酵母細胞周期中只有一種Cdk,而哺乳動物的細胞周期中有多種Cdk,所以哺乳動物的MPF是由Cdk1和周期蛋白B組成的複合物。 有絲分裂期細胞與間期細胞融合後,會使間期細胞產生形態各異的染色體凝集,稱作早熟染色體凝集。這一現象表明,分裂期細胞中可能存在某種誘導染色體發生凝集的因子。在成熟卵母細胞 分裂期黏菌 酵母等中提取到了這種促細胞分裂因子,稱為成熟促進因子(Maturation-promoting factor)。MPF是由催化亞單位和調節亞單位組成。催化亞單位是由cdc2基因編碼的一類蛋白質,只有與調節亞單位結合後,才具蛋白激酶活性,促使細胞進入分裂期。調節亞單位是一類隨細胞周期變化而周期性出現或消失的蛋白質,稱為細胞周期蛋白,它具有細胞周期特異性及細胞類型特異性。
關於MPF的研究
20世紀中葉,隨著DNA雙螺鏇結構的發現和遺傳信息中心法則的確立,產生了以核酸和蛋白質為主要研究對象的分子生物學。1960年代晚期,在華盛頓大學工作的科學家哈特韋爾,利用酵母遺傳學和分子生物學方法開始尋找控制細胞周期的基因。他和他的同事把一種單細胞生物——芽殖酵母(S. cerevisiae)放在不同的溫度下生長,得到了許多種類的溫度敏感突變株,其中有一些突變株停止在細胞周期某些特定的階段。哈特韋爾回憶說,“我們立刻被它們(溫度敏感突變株)所顯示出來的關於細胞分裂的大量信息所震驚。”
最初分析這些突變株的目的,是希望提出一系列相互連線和交叉的代謝途徑,以描述出一種細胞周期的代謝線路圖。這種想法的產生部分歸結於細菌和噬菌體遺傳學對噬菌體裝配系統成功的描述,這種描述揭示了噬菌體的頭部和尾部是如何進行裝配的,以及一些關鍵的蛋白質如何被用作其他蛋白質裝配的模板。人們可以想像,類似的一個過程銜接著另一個過程的線路,也同樣適用於細胞周期。1970年代初期,哈特韋爾實驗室從這些溫度敏感突變株內鑑定出了大量的破壞細胞周期進程的突變基因。這些溫度敏感突變體中的一種——cdc28突變株,被證明是了解從S期向M期轉換的關鍵。進一步的分析顯示,Cdc28基因的功能對細胞周期中的特定轉換是必須的。
在哈特韋爾進行這一系列研究的時候,納斯正在英國的一所大學讀研究生,從事胺基酸代謝方面的研究。當時的納斯對哈特韋爾的工作有著很深的印象:“我感到這種遺傳學方法非常有效。”得到博士學位後,納斯在英國愛丁堡大學開始了自己的研究生涯。
他選擇了另一種酵母——裂殖酵母(S. pombe),來尋找控制細胞周期的基因。這種酵母形狀像一個長的圓柱體,不斷在其中部形成隔膜,然後分裂成兩個細胞。細胞分裂發生在隔膜形成以後。通過採用與哈特韋爾相似的研究方法,納斯很快就發現一種稱為wee的細胞周期突變體,這種突變體細胞進入有絲分裂期後分裂成為比正常細胞小得多的子代細胞。他克隆到了wee的等位基因Cdc2,這是一個細胞周期進程所必須的基因。這類突變體的存在表明,Cdc2基因一定是非常重要的有絲分裂調控因子。在有絲分裂過程中,Cdc2不僅是開始其過程所必須的,而且還決定著有絲分裂期的時間長短。隨後的工作表明,Cdc2基因編碼一個分子量為34000的蛋白激酶。現在人們已知道,由蛋白激酶調節的蛋白質磷酸化,是真核細胞內改變酶和其他蛋白質活性最常見的過程之一。因此,蛋白激酶成為在細胞分裂過程中控制細胞結構和功能改變的重要手段。
後來的研究表明,Cdc2和Cdc28基因的序列相差無幾;預測的蛋白質胺基酸序列表明Cdc2和Cdc28蛋白彼此有很高的同源性,都屬於蛋白激酶家族的成員。分子生物學的研究結果證實,這兩個基因在這兩種親緣關係很遠的酵母菌中可以相互替代。1987年,納斯在人細胞中找到了與它們同源的Cdk1基因,它與Cdc2和Cdc28基因幾乎完全一樣,並且可以用來挽救裂殖酵母的cdc2突變株。這些研究表明,從低等生物到高等生物,細胞周期都是通過一個同樣的機制進行調控。一幅簡化的控制圖景可以描述為:特定的蛋白激酶啟動並磷酸化特定的蛋白質,這些蛋白質性質由此而來的改變,使得整個細胞從S期進入M期。這種模型也可以用來解釋細胞周期其他各個時相的轉換。
當然,不同有機體的細胞周期具體的控制機理並非完全一樣。在單細胞真核生物里,負責細胞周期內蛋白質磷酸化的蛋白激酶通常只有一種,芽殖酵母中是Cdc28,裂殖酵母里是Cdc2。而在多細胞真核生物中,參與細胞周期的蛋白激酶則有許多種。例如在人體細胞內,控制G1期的主要是CDK2、CDK4和CDK6,S期和G2期依賴於CDK2,而M期則主要由CDK1負責。
細胞周期蛋白(cyclin)
1953年霍華德等人首先提出細胞分化是通過細胞周期完成的理論;
1983年,Evans等首次在海洋無脊椎動物中發現一組蛋白質呈周期性出現,並調節細胞的生長,其被確定為細胞周期蛋白。
1988年科學家們發現細胞周期調節蛋白能與細胞分化周期編碼蛋白結合併激活相應的蛋白激酶,從而促進細胞分裂。
至少發現有11種不同的cyclin,分別為A、B1、B2、C、D1、D2、D3、E、F、G和H。其中8種主要的cyclin己被分離。根據cyclin調控細胞周期時相的不同,可分為G1期和M期兩大類。 各類周期蛋白均含有一段約100個胺基酸的保守序列,稱為周期蛋白框,介導周期蛋白與CDK結合。
(一)G1期胞周期蛋白(G1—cyclin)
1 cyclin D :
cyclin D1 ,cyclinD2 ,cyclin D3
2 cyclin C
3 cyclin E :cyclin E 1,cyclin E 2
1、cyclin D
cyclin D首先在酵母菌中被發現,它能激活CDK6,驅動細胞通過START。它有3個亞型,包括D1、D2、D3,具組織特異性。cyclin D1與cyclin D2功能相似,都在酵母子細胞中起作用,cyclin D3在酵母母細胞中起作用。 在細胞周期的調節中cyclinDl是一個比其它cyclins更加敏感的指標。
cyclin D1的編碼基因位於11q13上,全長約15kb,與其他周期素相比最小,主要是因為其N末端缺少一個“降解盒”片段,該蛋白半衰期很短,不足25min。
在有生長因子的情況下,cyclin D1在細胞周期中首先被合成,並於G1中期合成達到高峰, cyclln D1的功能主要是促進細胞增殖,是G1期細胞增殖信號的關鍵蛋白質,被視為癌基因,其過度表達可致細胞增殖失控而惡性化。
cyclinD2的編碼基因位於12p13,稱為CCND2,在正常的二倍體細胞及Rb陽性腫瘤細胞中cyclin D2的表達呈波動狀態,其峰值在G1晚期。
給G1期細胞微量注射cyclinD2抗體,可使表達cyclin D2的淋巴細胞停滯在G1期,說明cyclin D2是細胞從G1期向S期轉移所必須的。
cyclin D3的編碼基因位於染色體6p21,稱為CCND3。
正常和惡性組織中未見cyclinD3基因異常及其蛋白的過度表達。
目前認為cyclinD3似乎不直接反映惡性度,而是腫瘤發展到晚期的結果。
2、cyclin C
cyclin C與所有cyclin的同源性最低,主要在果蠅及人類細胞中發現,它與其他G1-cyclin不同的是其mRNA和蛋白質水平在G1早期達最高,可能在G1早期發揮作用。
3、cyclin E
cyclin E在cyclin D之後出現,於G1/S轉化過程中表達,人類cyclin E基因定位於染色體19q12-q13。cyclin E中1/3段為高度保守區,稱為周期蛋白盒,此為CDKs結合所必須。在G1晚期發揮正調控細胞周期的作用。cyclin E蛋白的C端存在PEST序列(一個富含脯氨酸(P)、谷氨酸(E)、天冬氨酸(S)、絲氨酸和蘇氨酸(T)殘基的PEST序列,在蛋白質轉化和降解中起作用) 。
cyclin E基因及其產物的表達在細胞周期的G1中期上升,至G1晚期或S早期達高峰,然後經與“PEST”序列有關的蛋白水解或與S期激酶相關蛋白-2 ( S-phase kinase-associated protein SKP2)泛素路徑降解而迅速下降。 缺乏SKP2的細胞表現cyclin E蛋白降解不足並不斷積累。
(二)M期細胞周期蛋白(M-cyclin)
1、cyclin A
cyclin A在cyclin E之後很快表達。cyclin A是G1期向S期轉移的限速因素,也可促進細胞從G2期向M期的轉化。它由CCNA基因編碼。
2、cyclin B
cyclin B是有絲分裂蛋白激酶的一個亞單位,能促進G2期向M期的過渡。哺乳動物cyclin B在S晚期合成。
cyclin A、cyclin B在M期通過泛素途徑降解,這是細胞脫離有絲分裂所必須。
cyclin A與cyclin B之間存在多種差異 :
(1)周期積累方式不同,cyclin A含量在S期及G2期初最高,cyclin B在G2期末含量最高;
(2)結合的催化亞基不同,cyclin A與p33cdc2結合,cyclin B與p34cdc2結合;
(3)功能不同,cyclin A在S期發揮作用,與DNA的複製完成有關,cyclin B在G2/M交界期發揮作用,誘發細胞分裂;
(4)對細胞分裂的影響不同,cyclin B持續升高可使細胞停滯於分裂期,而cyclin A的持續升高並不影響細胞分裂的完成。
細胞在生長因子的刺激下,G1期cyclin D表達,並與CDK4、CDK6結合,使下游的蛋白質如Rb磷酸化,磷酸化的Rb釋放出轉錄因子E2F,促進許多基因的轉錄,如編碼cyclinE、A和CDK1的基因。
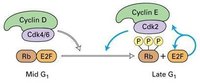 Cyclin D與CDK結合使Rb釋放結合的轉錄因子E2F
Cyclin D與CDK結合使Rb釋放結合的轉錄因子E2F在G1-S期, cyclinE與CDK2結合,促進細胞通過G1/S限制點而進入S期。向細胞內注射CyclinE的抗體能使細胞停滯於G1期,說明細胞進入S期需要CyclinE的參與。同樣將CyclinA的抗體注射到細胞內,發現能抑制細胞的DNA合成,推測CyclinA是DNA複製所必需的。
在G2-M期,cyclinA、cyclinB與CDK1結合,CDK1使底物蛋白磷酸化、如將組蛋白H1磷酸化導致染色體凝縮,核纖層蛋白磷酸化使核膜解體等下游細胞周期事件。
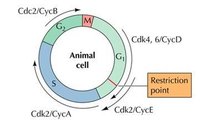 Cyclin的周期性變化
Cyclin的周期性變化在中期當MPF活性達到最高時,通過一種未知的途徑,激活後期促進因子APC,將泛素連線在cyclinB上,導致cyclinB被蛋白酶體(proteasome)降解,完成一個細胞周期。分裂期周期蛋白N端有一段序列與其降解有關,稱降解盒(destruction box,圖13-25)。當MPF活性達到最高時,通過泛素連線酶催化泛素與cyclin結合,cyclin隨之被26S蛋白酶體水解。G1周期蛋白也通過類似的途徑降解,但其N端沒有降解盒,C端有一段PEST序列與其降解有關。
泛素由76個胺基酸組成,高度保守,普遍存在於真核細胞,故名泛素。共價結合泛素的蛋白質能被蛋白酶體識別和降解,這是細胞內短壽命蛋白和一些異常蛋白降解的普遍途徑,泛素相當於蛋白質被摧毀的標籤。26S蛋白酶體是一個大型的蛋白酶,可將泛素化的蛋白質分解成短肽。
 Cyclin B的降解途徑
Cyclin B的降解途徑在蛋白質的泛素化過程中,E1(ubiquitin-activating enzyme,泛素激活酶)水解ATP獲取能量,通過其活性位置的半胱氨酸殘基與泛素的羧基末端形成高能硫酯鍵而激活泛素,然後E1將泛素交給E2(ubiquitin-conjugating enzyme,泛素結合酶),最後在E3(ubiquitin-ligase,泛素連線酶)的作用下將泛素轉移到靶蛋白上。參與細胞周期調控的泛素連線酶至少有兩類,其中SCF(skp1-cullin-F-box protein,三個蛋白構成的複合體)負責將泛素連線到G1/S期周期蛋白和某些CKI上,APC(anaphase promoting complex)負責將泛素連線到M期周期蛋白上。
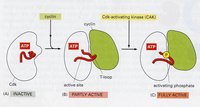
細胞周期素依賴激酶(CDK)
CDC2與細胞周期蛋白結合才具有激酶的活性,稱為細胞周期蛋白依賴性激酶(cyclin-dependent kinase,CDK),因此CDC2又被稱為CDK1,激活的CDK1可將靶蛋白磷酸化而產生相應的生理效應,如將核纖層蛋白磷酸化導致核纖層解體、核膜消失,將H1磷酸化導致染色體的凝縮等等。這些效應的最終結果是細胞周期的不斷運行。因此,CDK激酶和其調節因子又被稱作細胞周期引擎。
 細胞周期調控
細胞周期調控目前發現的CDK在動物中有7種。各種CDK分子均含有一段相似的激酶結構域,這一區域有一段保守序列,即PSTAIRE,與周期蛋白的結合有關。 CDK是一類重要的絲氨酸/蘇氨酸蛋白激酶,包括CDK1—7種。CDK的主要生物學作用是啟動DNA的複製和誘發細胞的有絲分裂,以複合物形式出現。
細胞周期蛋白依賴性激酶抑制劑(CKI)
細胞中還具有細胞周期蛋白依賴性激酶抑制因子(CDK inhibitor,CKI)對細胞周期起負調控作用,CKIS是CDK抑制蛋白,通過競爭性地抑制cyclin或cyclin—CDK複合物,導致cyclin生物學功能喪失;對細胞生長起負調控作用。目前發現的CKI分為兩大家族:
①Ink4(Inhibitor of cdk 4),如P16ink4a、P15ink4b、P18ink4c、P19ink4d,特異性抑制cdk4·cyclin D1、cdk6·cyclin D1複合物。
 P21cip1抑制CDK和PCNA
P21cip1抑制CDK和PCNA②Kip(Kinase inhibition protein):包括P21cip1 (cyclin inhibition protein 1)、P27kip1(kinase inhibition protein 1)、P57kip2等,能抑制大多數CDK的激酶活性,P21cip1還能與DNA聚合酶δ的輔助因子PCNA(proliferating cell nuclear antigen)結合,直接抑制DNA的合成 。
1、P16
p16INK4位於染色體9p21,又稱多腫瘤抑制基因(multiple tumor suppressor MTSI ),是CDK4的特異性抑制物,可與cyclin D競爭與CDK4或CDK6的結合,抑制CDK4對細胞生長分裂的正向作用,參與抑制細胞周期G1/S的轉化。p16在缺乏功能性Rb的細胞中水平上升,提示Rb可能抑制p16的表達,同時Rb刺激cyclin D的表達。
2、p15INKB
p15INKB位於9號染色體緊鄰p16的區域,它與p16一樣屬抑癌基因。
3、P27
P27可能是最直接地影響G1/S期限制位點的調控。廣泛抑制cyclin—CDK複合物。
正常情況下P27在G0/G1時表達增高,進入S期後表達下降。其基因定位於染色體12p13.1及12p13.2處,人的p27cDNA全長594bp,編碼198個胺基酸,是高度保守的蛋白分子,在人、鼠、貂中p27的胺基酸主序列有90%同源性,其C末端均含有一個雙枝核定位信號。其N末端介導抑制CDK,約12-87胺基酸主序列與p21同源。P27與p21在N端序列上有42%相同,但是P27介導抑制CDK的區域與p21不盡相同。 p27還參與對細胞分化的調控:
同p21一樣它可誘導未成熟細胞進行分化;
p27也可誘導腫瘤細胞分化(如外源性p27可誘導原巨核細胞白血病細胞分化);
p27不能誘導成熟正常細胞的衰老。
p27表達水平受多種因素調控,如有絲分裂原、抗增殖信號因子、細胞因子、癌基因子及接觸抑制等。
TGF-β和接觸抑制能共同調控轉錄 p27和p15,其負調節信息的共同通路是抑制CDK和G1—cyclin功能,發揮CKI抑制作用。
TGF-β對p27表達的影響是雙相的,在大多數細胞中,TGF-β可誘導p27的表達,但是在正常垂體前部和垂體瘤細胞中,TGF-β可下調p27mRNA及蛋白的表達。
PDGF、EGF等也可下調p27的表達。
p27對細胞周期的調控主要依賴於其蛋白表達水平,而非基因突變。p27的表達下降或缺失會引起基因組不穩定,甚至導致腫瘤發生。
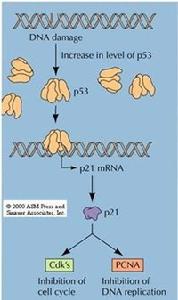
4、p21
p21基因位於染色體6p21.2,第17-71胺基酸含有cyclin結合抑制區。p21可能阻礙細胞進入S期;能抑制SAPK(stress-activated protein kinase),參與細胞應激狀態時的信號轉導級聯繫統的調節
 CKI作用圖
CKI作用圖2001年度諾貝爾生理學或醫學獎,授予了美國西雅圖弗雷德·哈欽森(Fred Hutchinson)癌症研究中心的哈特韋爾(L. Hartwell),英國帝國癌症研究基金會的亨特(T. Hunt)和納斯(P. Nurse),以表彰他們在細胞周期研究中的卓越成就。
 2001年諾貝爾生理醫學獎獲得者
2001年諾貝爾生理醫學獎獲得者細胞周期調控中各元素間的相互作用
細胞周期的調控可分為外源和內源性調控, 外源性調控主要是細胞因子以及其它外界刺 激引起; 內源性調控主要是通過Cyclin—CDK—CDI的網路調控來實現。 各種細胞周期蛋白隨特定細胞時相而出現:G1早期,cyclinD表達並與CDK2或CDK4結合,成為 始動細胞周期的啟動子;
G1晚期、進入S早期後cyclinE表達,並與CDK2結合,推動細胞進入S期;
進入S期後,cyclin A表達,cyclinD、cyclin E降解;
S晚期、G2早期,cyclIin A、cyclin B表達,並與cdc2結合,促進細胞進入M期。
cyclin A 和CDK2相結合可以調節S期進入G2期;
cyclin Bl—2可與CDKl結合併在G2/M轉化期間活性達到最高峰;
與cyclin C匹配的CDK及其酶解底物尚不清楚;
cyclinH與cyclinC有較高的同源序列,可以和CDK7裝配成全酶對細胞周期各階段行使調節作用。
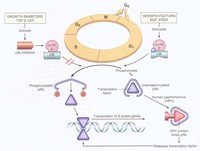
細胞轉錄因子(E2F)
在E2F基因活化轉錄功能區內有一段18個胺基酸的序列可與Rb結合,Rb通過與E2F功能區的結合遮蓋其功能區,抑制其活性轉錄功能,抑制DNA合成。
E1A的介入,釋放出更多的游離E2F,影響著一些與轉化表型有關的特定基因表達。
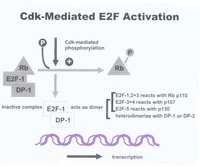 E2F作用圖解
E2F作用圖解Rb基因
Rb基因位於人類染色體13q14,其轉錄產物Rb蛋白是主要的轉錄信號連線物,在細胞周期中起制動器功能。
它能與轉錄因子E2F結合併阻止相應基因轉錄表達,從而抑制細胞生長。
cyclin D是Rb調節細胞周期的基礎。cyclin D1-CDK4複合物可看做G1期Rb蛋白激酶,它能結合Rb的N末端,磷酸化Rb蛋白,使轉錄因子釋放,導致G1/S轉化。
相互作用舉例
P21結合併抑制多種cyclin-CDK複合物,負性調節CDK功能,實驗證明,正常細胞多數cyclin-CDK複合物都與p21結合,而多數轉化細胞中則不結合。
P21是P53作用的靶點,p21啟動子含有P53結合位點。G1期DNA損傷可激活p53,誘導P21轉錄,導致cyclin D-CDK4和cyclin E-CDK2抑制,從而阻止細胞進入S期,使損傷DNA得到修復。 p21在p53介導的DNA損傷所致的G1期停滯中起重要作用。
CAK ( CDK激活酶)可誘導CDK磷酸化,而p27通過與CDK亞單位的結合,使CAK不能與CDK直接發生作用。非活化的CDK不能使Rb蛋白磷酸化,使細胞停留在G1期,對細胞周期進行負調控。
P27還可阻止Rb蛋白磷酸化,其過度表達能抑制細胞進入G1期。
p27在調節細胞進入和退出M期中起重要作用,抗絲裂原環境中細胞生長停滯與p27—CDK2複合物的量相關。
細胞周期檢測點的調控
細胞在長期的進化過程中發展出了一套保證細胞周期中DNA 複製和染色體分配質量的檢查機制, 通常被稱為細胞周期檢測點(check point)又稱為限制點(restriction point) 。這是一類負反饋調節機制。當細胞周期進程中出現異常事件, 如DNA 損傷或DNA 複製受阻,這類調節機制就被激活, 及時地中斷細胞周期的運行, 待細胞修復或排除了故障後,細胞周期才能恢復運轉。保證了在細胞周期中上一期事件完成以後才開始下一期的事件。
細胞周期檢測點的作用:
細胞周期檢測點(checkpoints)構成了DNA修復的完整元件。
檢測點通過延緩細胞周期的進展,為DNA複製前的修復、基因組的複製、有絲分裂及基因組的分離提供更多的時間。
檢測點功能的丟失或減弱可能通過降低DNA複製效率來增加和誘導基因突變和染色體畸變。在某些遺傳性癌症和細胞轉化早期中,已經觀察到檢測點調控的缺失,後者可能導致遺傳失穩態,促使向新生物轉化。
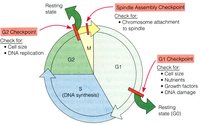 細胞周期的生化事件與檢驗點
細胞周期的生化事件與檢驗點G1-S期檢測點
G1-S期檢測點是最重要的檢測點。細胞在該檢測點對各類生長因子、分裂原以及DNA 損傷等複雜的細胞內外信號進行整合和傳遞,決定細胞是否進行分裂、發生凋亡或是進入G0 期。
細胞順利完成其周期需經過若干檢測點,其中最重要的控制點是G1晚期的START,START調節失靈,將導致細胞越過正常的程式限制進入s期,並允許細胞複製未修復的突變DNA,從而積累形成腫瘤表型的基因改變。
G1-S 期檢測點缺陷導致腫瘤的原因主要是p53 缺失和cyclinD1上調。 失去調控的癌細胞傾向於保留在細胞周期中持續循環;一旦細胞通過G1晚期限制點,將對胞外生長調控信號產生不應期而代之以自律性程式,並帶著這些信息進入有絲分裂。對限制點調控的研究是搞清癌細胞是怎樣和為何持續進入循環的關鍵所在。
 G1-S期檢驗點
G1-S期檢驗點S期檢測點
控制進入S期的檢測點(Gl期檢測點)可防止DNA受損的細胞進入S期。
G2期檢測點
控制進入M期的檢測點(G2期檢測點)可防止受損的DNA和未完成複製的DNA進入有絲分裂。p53 是DNA 損傷誘導G2 期阻滯的關鍵機制,因此p53 缺失導致的G2 期檢測點缺陷與許多腫瘤的發生有關。
M期檢測點
M 期檢測點又叫紡錘體組裝檢測點。主要是阻止細胞分裂、阻止細胞兩極形成紡錘體、阻止染色體附著到紡錘體上。
細胞周期檢測點功能的減弱,會導致突變基因的累積和遺傳的不穩定性,但只有當累積的突變基因破壞了細胞周期驅動機制時,細胞才能進入失控性生長。

