前言介紹
科技文明不停的進步,人口不斷的增加以及為了追求更美好的生活,人們不停的增加能源的使用量,使得石化燃料(石油、煤炭、天然氣等)日已枯竭,大量的使用石化燃料也衍生出許多問題如:空氣污染、酸雨以及溫室效應等問題。據統計,以現今石油消耗的速度,地球上的石油儲存量最多能再用40到50年,為了避免屆時世界陷入難以估計的經濟恐慌,各國提出了各種以綠色能源取代石化燃料的方案。
目前世界上綠色能源有太陽能、風力、水力、潮汐、地熱、生物能以及氫能等。但太陽能轉化效率不高、製造過程複雜生產成本昂貴;而風力會受到地形天候限制;水力發電建設費用相當高,且在河流上建造水壩會破壞河流生態;地熱又少;因此在這些綠色能源中以燃料電池最具發展潛力。
燃料電池能夠套用的領域相當廣泛,包括電力、工業、運輸、太空、軍事、通訊產品等等。目前許多國家都在發展燃料電池,經過多年研究以及技術改良現在燃料電池技術已經進入商業化階段,未來極有可能成為最重要的綠色科技之一。
發展歷史
燃料電池技術起源於1838年,C. F. Schonbein發現了燃料電池的電,氫氣與白金電極上的氯氣或氧氣發生的化學反應能產生電流,並將這種現象命名為極化效應。
1839年,Willian Grove設計了一款氣體電池,他的基本構想來自於水的電解反應,水電解之後產生氧氣和氫氣,若將電解反應逆轉則能產生電流,於是用兩條白金分別放入兩個密封的瓶子中,一瓶充滿氫氣,一瓶充滿氧氣,將兩容器浸入稀硫酸溶液時,電流便在兩個電極之間流動,為了提高裝置產生的電壓,就將四組裝置串聯起來,此裝置就是後來全世界公認的第一個燃料電池。
1899年,Nernst提出將固態氧化物當做電解質用於燃料電池之中。
1959年,Francis T. Bacon 製作出一個5KW的燃料電池,能夠推動電焊,電鋸以及堆高機,使燃料電池技術走出實驗室。
1960年美國太空署為了發展太空科技而開始將燃料電池實用化。
1965年氫燃料電池正式套用在太空船雙子星五號上,為美國太空計畫中的電力提供系統,因產物是純水也為太空人提供飲用水。此後燃料電池在太空行動如阿波羅7~17號中均起到重責大任。
1973年發生石油能源危機,各國開始認識到能源的重要性,紛紛擬定各種能源政策以期望降低對石油的依賴。燃料電池因其高的能源轉化率而引起各國重視。
1980年代環保意識的高漲,開法綠色能源技術使人類的發展不用受限於有限的天然資源,也可以讓人類在享受能源提供生活便利的同時還能維持一個良好的生活環境,燃料電池以其低污染的特性再次走入大眾視野。
現今燃料電池生產狀況並不輕鬆,與化石燃料的競爭過於激烈。而且受制於成本問題,除非國家政策扶植力度大,否則很多燃料電池企業都很難盈利甚至虧損。如FuelCell能源公司2010年就在燃料電池領域虧損。但是燃料電池的優勢還是十分顯著的,環保方面的零排放,套用範圍之廣,無論大到發電廠,還是汽車,還是小到電子消費產品都可以使用燃料電池。業內認為,隨著今後數十年的發展,再配合液態氫基礎設施網路的建設和完善,燃料電池就會變得更穩定廉價,燃料電池發展的真正春天也就來了。
發電原理
燃料電池嚴格來說並非電池,算是發生電化xue反應的媒介,一種發電裝置。因為所參與電極反應的活性物質不能儲存於電池內部,而是由電池之外供應,所以只要燃料xue不斷輸入,電力就會不斷的輸出。
 甲烷燃料電池
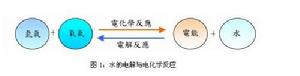
甲烷燃料電池燃料電池的主要燃料通常以氫氣為主,氫氣與氧氣通過電化xue反應發生氧化作用輸出電能、純水和熱量,如圖1
圖1:水的電解與電化xue反應
由圖可以看出由於直接將化xue能轉化為電能,不需要經過多次轉換,而且沒有卡諾循環的限制,所以節省了轉換為機械能浪費的能量損失,因此比內燃機多了30%以上的能量轉換效率,目前效率可達70%,若加上熱回收利用,更可高達85%,渴望成為最具經濟效益的能源。
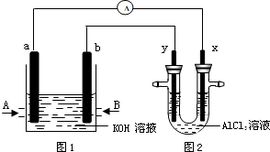
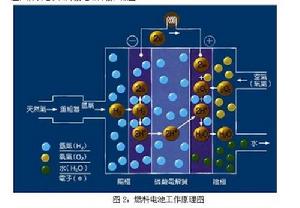
燃料電池的基本原件是兩個電極夾著一種具有滲透性的電解質,兩電極通常加入碳粉、鉑等觸媒作為催化劑加速氫、氧分子分解為電子及離子,電解質作為離子的通道用,其傳輸效率越高則電流密度越高;而電解質對於電子的傳輸效果差,所以電子由外接電路傳輸,如圖2
 甲烷燃料電池
甲烷燃料電池圖2:燃料電池工作原理圖
電池分類
現今燃料電池出現多種形式,人們依據電解質的不同將燃料電池分為鹼性燃料電池、磷酸燃料電池、熔融碳酸鹽燃料電池、固態氧化物燃料電池、質子交換膜燃料電池以及甲醇燃料電池等。也有依據操作溫度的高低來區分為高溫型(>300℃)、中溫型(150~ 300℃)以及低溫型(< 150℃),但通常以電解質類型來區分。以下針對一些燃料電池作簡單說明:
鹼性燃料電池
最早是在1925年由 Dr. Francis Thomas Bacon 開始發展,一般被運用於人工衛星、航天及軍事等用途上。因氧氣在鹼性溶液中的活性大於在酸性溶液中,所以可以使用非貴金屬如銀、鎳等作為電極材料。但電解質溶液為強鹼會與空氣中的二氧化碳生成碳酸鹽而沉積在多孔電極上造成堵塞,所以須以純氫氣作為陽極燃料,以純氧氣作為陰極的氧化劑。
磷酸燃料電池
有第一代燃料電池之稱。使用濃磷酸為電解質的酸性溶液燃料電池,所以電池性能不受二氧化碳的影響,因此可將空氣直接提供給陰極。目前大都運用在發電機組上,雖已商業化生產,但因為成本始終居高不下,而未能普遍。
熔融碳酸鹽燃料電池
鹼金屬碳酸鹽只有在熔融狀態時,才能發揮離子傳導的功能,所以操作溫度須在熔點以上。在操作溫度下,陰極的二氧化碳與氧氣發生反應形成CO32 -,CO32 -經電解質導引至陽極與氫氣反應,生成二氧化碳及水蒸氣。二氧化碳經陽極回收後,可再循環至陰極使用。由於熔融鹽燃料電池反應容易,不需以昂貴的金屬作為觸媒,使用鎳及氧化鎳即可。
固態氧化物燃料電池
固態氧化物燃料電池有第三代燃料電池的稱號,電解質為固態、無孔隙的金屬氧化物,由氧離子在晶體中穿梭來傳送離子,電池本體材料局限於陶瓷或金屬氧化物。目前技術已進入成熟穩定階段,但僅有少數材料可於高溫下長期運轉且價格昂貴,因此有朝中溫型電池的方向發展的趨勢。
質子交換膜燃料電池
水是內部唯一的液體,雖無腐蝕的問題,但水的管理是影響燃料電池工作的重要因素。由於薄膜必須含水,所以燃料電池的操作溫度必須限制在水的沸點一下,且水的產生速率需高於揮發速率,使薄膜保持充分含水的狀態。
直接甲醇燃料電池
目前氫氣大多來自於甲醇的蒸汽重組,因此近年來有人將之改良成直接使用甲醇做為燃料的燃料電池。
甲烷燃料電池
甲烷是無色、無味的氣體是最簡單的有機物,別名:天然氣,沼氣。也是含碳量最小(含氫量最大)的烴,是沼氣,天然氣,瓦斯,坑道氣和油田氣的主要成分,對空氣的重量比是0.54,比空氣輕約一半。甲烷溶解度很小,燃燒時產生明亮的深藍色火焰。有輕微的毒性。
實驗室中可用醋酸鈉與氫氧化鈉混合加熱生成碳酸鈉與甲烷的方法來製備少量甲烷。大量製備甲烷,可將有機質放入沼氣池中,控制好溫度和濕度,經過甲烷菌快速繁殖,將有機質分解成甲烷、二氧化碳、氫、硫化氫、一氧化碳等,其中甲烷占60%-70%。經過低溫液化,將甲烷提出,可製得廉價的甲烷。
甲烷燃料電池是化電池中的氧化還原電池,就是用沼氣(主要成分為CH4)作為燃料的電池,與氧化劑O2反應生成CO2和H2O。反應中得失電子就可產生電流從而發電。美國科家設計出以甲烷等碳氫化合物為燃料的新型電池,其成本大大低於以氫為燃料的傳統燃料電池。燃料電池使用氣體燃料和氧氣直接反應產生電能,其效率高、污染低,是一種很有前途的能源利用方式。但傳統燃料電池使用氫為燃料,而氫既不易製取又難以儲存,導致燃料電池成本居高不下。科研人員曾嘗試用便宜的碳氫化合物為燃料,但化反應產生的殘渣很容易積聚在鎳制的電池正極上,導致斷路。美國科家使用銅和陶瓷的混合物製造電池正極,解決了殘渣積聚問題。這種新電池能使用甲烷、乙烷、甲苯、丁烯、丁烷等5種物質作為燃料。
反應方程式
鹼性介質下的甲烷燃料電池
 甲烷燃料電池
甲烷燃料電池負極:CH4+10OH- -8e-===CO3 2-+7H2O
正極:2O2+8e-+4H2O===8OH-
離子方程式為:CH4+2O2+2OH-===CO32-+3H2O
總反應方程式為:CH4+2O2+2KOH===K2CO3+3H2O
酸性介質下的甲烷燃料電池
負極:CH4-8e-+2H2O===CO2+8H+
正極:2O2+8e-+8H+===4H2O
總反應方程式為:2O2+CH4===2H2O+CO2
反應情況:
1.隨著電池不斷放電,電解質溶液的酸性減小;
2.通常情況下,甲烷燃料電池的能量率大於甲烷燃燒的能量利用率。
甲烷燃料電池化學方程式
CH4+2O2+2OH-==CO32-+3H20
①就是CH4在O2中燃燒,生成的CO2和OH-反應生成CO32-的離子反應方程式接著寫正極,記住:正極在鹼性條件下的反應一定是:O2+4e-+2H2O==4OH-
②接著將總反應式減去正極反應式就是負極反應式,這裡有一點非常重要,就是一定要將O2消去,因為原電池負極發生氧化反應,而O2發生還原反應 故一定要將O2消去將②X2 得到 2O2+8e-+4H2O===8OH-
③①-③ 得到CH4-8e--4H2o+2OH-==CO32-+3H2O-8OH-移項的到負極反應式:CH4+10OH--8e-==CO32-+7H20總反應:CH4+2O2+2OH-==CO32-+3H20負極:CH4+10OH--8e-==CO32-+7H20正極:O2+4e-+2H2O==4OH-
套用前景
歷史
燃料電池(Fuel cell),是一種使用燃料進行化學反應產生電力的裝置,最早於1839年由
英國的Grove所發明。最常見是以氫氧為燃料的
質子交換膜燃料電池,由於燃料價格平宜,加上對人體無化學危險、對環境無害,發電後產生純水和熱,1960年代套用在
美國軍方,後於1965年套用於美國雙子星座計畫雙子星座5號飛船。現在也有一些筆記型電腦開始研究使用燃料電池。但由於產生的電量太小,且無法瞬間提供大量電能,只能用於平穩供電上。
發展前景
 甲烷燃料電池
甲烷燃料電池。燃料的選擇性非常高,包括純氫氣(H2)、甲醇(CH3OH)、乙醇(CH3CH2OH)、天然氣,甚至於現在運用最廣泛的汽油,都可以作為燃料電池的燃料。這是目前其他所有動力來源無法做到的。而以燃料電池做為汽車的動力,已被公認是廿一世紀必然的趨勢。
燃料電池則是以具有可燃性的燃料與氧反應產生電力;通常可燃性燃料如瓦斯、汽油、甲烷(CH4)、乙醇(酒精)、氫等這些可燃性物質都要經過燃燒加熱水使水沸騰,而使水蒸氣推動渦輪發電,以這種轉換方式大部分的能量通常都轉為無用的熱能,
轉換效率通常只有約30%相當的低,而燃料電池是以特殊催化劑使燃料與氧發生反應產生二氧化碳(CO2)和水(H2O),因不需推動渦輪等發電器具,也不需將水加熱至水蒸氣再經散熱變回水,所以能量轉換效率高達70%左右,足足比一般發電方法高出了約40%;優點還不只如此,二氧化碳排放量比一般方法低許多,水又是無害的產生物,是一種低污染性的能源。
甲烷做燃料電池電極方程式溶液
甲烷燃料電池的電解質溶液為KOH,生成的CO2還要與KOH反應生成K2CO3,所以
總反應為:CH4 + 2KOH+ 2O2 = K2CO3 + 3H2O。
負極:CH4 – 8e- + 10OH- == CO32- +7H2O,
正極:2O2 + 4H2O + 8e- = 8OH-