定義
指組成原子不存在結構上的長程有序或平移對稱性的一種無定型固體狀態。
玻璃態可以看成是保持類玻璃特性的固體狀態。
玻璃態轉變
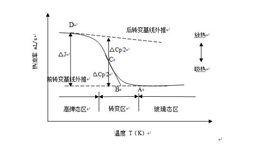
玻璃轉變是玻璃態物質與其他物質不同的特徵現象,也是凝聚態物理研究領域中的重點和難點問題之一,玻璃轉變過程中的一個顯著特徵是發生熱力學參量的變化,熔體凝固可以通過兩條路徑進行,通常熔體在凝固溫度點附近形核並長大成晶態物質。從熔融態到固態的變化過程中,系統的一級熱力學參量(如體積和焓等)會在熔點溫度發生突變。如果冷卻速度足夠快或難以形核,以至於液體來不及成核和長大,即使到了熔點以下也仍然保持高溫時的狀態,即液體凝固通過另一條途徑進入過冷狀態,此時的液體稱為過冷液體,在冷卻成玻璃的過程中其體積和焓等表現出連續變化的特點。從時間尺度來看,過冷液體在相空間是各態歷經的準平衡態, 玻璃態在可觀測的時間範圍內是各態歷經的非平衡態。和一級熱力學參量形成顯著對比的是,體系的二級熱力學參量(如比熱和熱膨脹係數等)會發生突變而形成比熱台階,比熱台階的存在是確認玻璃態最有力的證據之一. 然而,熱力學玻璃轉變不是二級相變,至今仍然沒有觀察到其對應的有序參量變化。和其他物質不同,玻璃態物質由液體轉變為固體不是在一個特定的溫度點進行,而是對應一個溫度區間(即轉變溫度範圍)。在此溫度範圍內,玻璃由黏性體經黏塑性體、黏彈性體,最終逐漸轉變成彈性體。
玻璃轉變的另一個顯著特徵是具有明顯的動力學變化。當過冷液體趨向於玻璃轉變溫度時,黏度隨溫度發生連續劇烈變化(瞬間增加十幾個數量級)。
傳統的玻璃轉變理論主要以α弛豫為基礎,近年來的研究發現慢β弛豫行為是玻璃轉變更微觀的誘導和基礎。
此外,除了α弛豫和β弛豫,一些特殊的弛豫過程如“過剩翅”等也引起了廣泛關注,各種理論模型層出不窮,如唯象特徵、自由體積模型、熱力學統計模型、固體模型理論、能量勢壘理論以及模態耦合理論等。
所有這些理論模型都有其合理性且都對玻璃態物質本質的理解有所幫助,但仍都存在一定的局限性。比如,自由體積模型能夠很好地解釋玻璃轉變附近的黏度和熱熔隨溫度的變化關係,但是由於參數單一且在實驗室難以測量,因而不能完整描述玻璃轉變的特徵並且不能解釋清楚過冷液體的不均勻性、弛豫和微觀機理。模態耦合理論在提出之初準確描述了玻璃轉變溫度以上高溫熔體的弛豫,但是在預測熔體結構將在交叉區溫度處被凍結這一點上卻與實驗結果不符。儘管此後通過引入多個變數來進行改進,但同樣仍存在其他諸多問題。此外,對於過冷液體在如此短的時間內黏度劇增而結構卻變化不大這一動力學變化的本質也缺乏徹底的理解,而實驗上測試遠低於玻璃轉變溫度下的弛豫時間仍然是一個難點,玻璃轉變的核心問題在於對玻璃弛豫現象的理解,如何透過這些不同的實驗現象深入剖析其內在本質並理清它們之間的聯繫和區別是未來需要面對的一個巨大挑戰。
形成
 玻璃態
玻璃態無機玻璃是人類最早合成的無機材料之一,大多數高分子聚合物也都屬於玻璃態。生成玻璃態的氧化物主要是電負性居中的元素,如硼、矽、鍺和磷等。這些元素與氧形成很強共價鍵,並構成較為開放的三維網路結構,即使溫度在材料的熔點以上,這種共價鍵仍然存在,只是體系中不存在有任何長程有序或平移對稱性。這些氧化物的熔融狀態具有很高的黏度,在體系溫度降低時,容易處於過冷狀態,使長程無序得以在固相中保持。過冷液態轉變為玻璃態的溫度稱為玻璃化溫度。一些玻璃在低於玻璃化溫度經長時間退火,可以使玻璃態向晶態轉變,這種現象稱為失透。在上述氧化物中加入鹼金屬氧化物可以在一定程度上打破原有的三維網路,使玻璃化溫度降低。人們對矽酸鹽玻璃進行了較多的研究,認為在玻璃態下,仍保持著矽氧四面體的結構,但是矽氧四面體之間存在有不同程度的扭曲和旋轉,形成無序的三維網路。
當聚合物材料受到外力作用時,只能通過改變主鏈上的鍵長、鍵角去適應外力,因此聚合物表現出的形變能力很小。形變數與外力大小成正比,外力一旦去除,形變立即恢復。由於該狀態下聚合物表現出的力學性質與小分子玻璃很相似,所以將聚合物的這種力學狀態稱為玻璃態。鏈段運動處於被凍結的狀態,只有鍵長、鍵角、側基、小鏈節等小尺寸運動單元能夠運動。
特性
1、各向同性:由於玻璃具有統計性均勻結構,在不同方向上具有相同數值性質,如折射率、硬度、彈性模數、介電常數,在無內應力下具有雙折射現象。
2、加熱時逐漸軟化:由脆態進入可塑態、高黏態、最後成為熔體,黏度是連續變化的。
3、熔融和凝固是可逆的:反覆加熱到熔融態,又按同一制度加熱和凝固,如不產生分相和結晶,會恢復到原來的性質。
4、玻璃態的內能比晶體大:在合適的溫度條件下,玻璃有結晶是傾向,在液相線以下溫度,玻璃結晶是自發的,無需外界做功。
5、玻璃性質在一定範圍內隨成分發生連續變化:由此可以改變成分來改變玻璃的性質,如普通矽酸鹽玻璃是絕緣體,但硫族玻璃為半導體,As2Te3在27℃下的電導率高達10s/m
物理狀態
玻璃狀態,表面看上去是固體,實際上並不是。50多年來,科學家一直在嘗試弄清玻璃的本質。2008年,英國、澳大利亞及日本的科學家聯合研究發現,玻璃無法成為固體的原因在於玻璃冷卻時所形成的特殊的原子結構。相關論文2008年6月22日線上發表於《自然—材料學》(Nature Materials)上。
主要研究人員、英國布里斯托大學的Paddy Royall說:“一些材料在冷卻時會形成結晶,其原子會以高度規則的模式進行排列,稱為“晶格”(lattice)。不過玻璃在冷卻時,原子擁堵在一起,幾乎隨機排列,妨礙了規則晶格的形成。”
在實驗中,為了觀察微觀原子的真實運動情況,研究人員利用較大的膠體微粒模擬原子,並用高倍顯微鏡進行觀察。結果發現,這些粒子形成的凝膠因為構成了二十面體結構而無法形成結晶——這與20世紀50年代布里斯托大學的Charles Frank作出的預測相一致。這種結構解釋了為什麼玻璃是“玻璃”而不是液體或固體。
此次研究對於理解亞穩態材料來說是個重大的突破,它將使進一步開發金屬玻璃等新材料成為可能。另外,如果能夠通過操作使金屬在冷卻時形成玻璃一樣的內部結構,將有可能大大減少金屬缺陷1。(科學網 梅進/編譯)
(《自然—材料學》(Nature Materials),doi:10.1038/nmat2219,C. Patrick Royall,Hajime Tanaka)