外延
大麻素的外延包括結構上與四氫大麻酚(Tetrahydrocannabinol,THC)相關或與大麻素受體(Cannabinoid receptor)結合的一組物質。
來源
大麻素據其來源分為3類:天然植物成分、人工合成物及內源性大麻素類。
受體
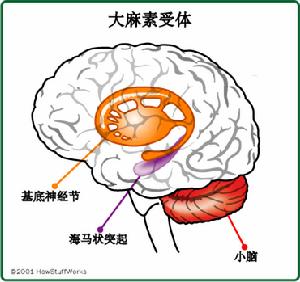 大麻受體
大麻受體目前公認的大麻素受體有:CB1、CB2受體,20世紀90年代初分別克隆了體內與之結合的大麻素CB1和CB2受體。cb1受體由473個胺基酸,7個跨膜結構域構成,CB2受體由360個胺基酸,7個跨膜結構域構成,均屬於G蛋白偶聯受體。基因克隆研究發現這兩種受體有44%的胺基酸序列同源。人類大麻素受體與大鼠的大麻素受體胺基酸序列有很高的同源性,因此,成年大鼠可作為研究大麻素受體分布及功能的理想實驗動物。
CB1受體主要位於腦、脊髓與外周神經系統中,又稱中樞型大麻素受體。腦內CB1受體主要分布於基底神經節(黑質、蒼白球、外側紋狀體)、海馬CA錐體細胞層,小腦和大腦皮質。它的激活可以降低神經遞質的釋放,如多巴胺和GABA,來參與記憶、認知、運動控制的調節。
CB2受體主要分布在外周,如脾臟邊緣區、免疫細胞、扁桃體、胸腺等,又稱外周型大麻素受體。有研究表明,CB2受體在大鼠的毛表皮和毛囊組織也有分布,可能參與了皮膚的某些生理病理過程。它由360個胺基酸組成,儘管比CB1短得多,但仍然是典型的G蛋白偶聯受體。它的作用主要包括調節中樞神經系統內外的細胞因子釋放和免疫細胞遷移。研究發現,CB2大麻素受體還對熱刺激的傷害感受具有保護作用。
由此可見,CB1受體和CB2受體共同的作用都是調節化學遞質的釋放,只是CB1受體主要來源於神經細胞,CB2受體主要來源於免疫細胞。
除了CB1和CB2受體以外,研究者們還觀察到一些其它類型的大麻素受體,但它們至今還沒有被克隆,其活性作用也不是很清楚。
大麻素受體激動劑
大麻素受體激動劑可以分為以下四類:
①經典大麻素受體激動劑,如△9-THC、△8-THC、HU-210等。
②非經典大麻素受體激動劑,如CP47497、CP55940等。其中,CP55490已經成為主要的激動劑之一,CB1受體就是通過[3H]CP55490發現的。現在,[3H]CP55490仍舊是最常使用的放射示蹤大麻素配體。
③氨基烷基吲哚類大麻素受體激動劑。R-(+)-WIN55212是這一類別中研究最透徹的一個,它對兩種CB受體都有高親和性。老鼠大腦內的大麻素受體就是通過[3H]R-(+)-WIN55212測定法來鑑定的。
④十二烷類大麻素受體激動劑,如anandamide。
大麻素受體拮抗劑
大麻素受體拮抗劑主要分為兩類:
①二芳基吡唑類大麻素受體拮抗劑。這類化合物的代表物是高效CB1受體選擇性配體SR141716A和CB2受體選擇性配體SR144528,它們分別能夠阻止或逆轉由CB1和CB2受體所介導的作用。SR141716A的類似物AM251和AM281也被套用於抑制CB1受體的介導作用。
②其他結構的CB受體拮抗劑,如LY320153、AM630等。和SR141716A相比,LY320153對CB1受體具有更高的選擇性,但親和力較弱。AM630是CB2受體選擇性拮抗劑。
作用
大麻素在神經系統疾病中的套用:鎮痛、腦外傷、缺血性腦卒中、多發性硬化、帕金森病、阿爾茨海默病、亨廷頓病、癲癇、肌萎縮側索硬化、睡眠障礙等。另外,大麻素還可用於心血管疾病、治療青光眼、抗哮喘、止吐、刺激食慾。然而,將大麻素作為藥物使用也遇到了一些問題,如大麻對中樞神經產生的精神效應;大麻素對使用者的學習記憶、情緒等產生較大的影響。因其作用效果和機理相當複雜性,國際社會對於醫用大麻素的合法化使用一直爭論不休。
關於毒癮
 抽大麻的人為什麼會在時空中迷失
抽大麻的人為什麼會在時空中迷失研究人員發現,SCN神經細胞中具有大麻素類物質的受體。研究人員隨後對SCN神經細胞進行了研究。當他們向一個皮氏培養皿中的小鼠SCN神經細胞加入大麻素類物質後,這些細胞中有50%變得更為活躍。研究人員在《神經科學雜誌》網路版上報告說,這些增加的活性很可能擾亂了一隻小鼠的晝夜節律。
研究小組相信大麻素類物質可能對人體也能夠產生類似的影響。van den Pol指出,當人們吸食大麻時,他們往往會失去對時間的概念。他說,這可能是因為毒品中的大麻素類物質使吸毒者的SCN神經細胞被不規律地激活,進而擾亂了其體內的生物鐘。
美國伊利諾州埃文斯頓市西北大學的晝夜節律研究人員Joseph Bass表示,這項工作支持了這樣一種理論,即使人上癮的物質能夠影響人體的晝夜節律。有意思的是,這看起來似乎是必然的,但直到最近,有關上癮物質的研究才瞄準大腦的獎賞系統。Bass指出,能夠影響獎賞系統和晝夜節律的分子證據才剛剛出現。
內源性大麻素
成員
大腦中一些被公認的內源性大麻素已被分離,包括anandamide、2-AG、noladinether、virodhamine和N-arachidonoyldopamine(NADA)。其他內源性大麻素類化合物包括相關的脂肪酸衍生物oleamide、palmitoylethanolamide和一個新的arachidonoyl胺基酸家族。這些物質缺少與大麻素受體的親和力,但卻能促進內源性大麻素的功能。
分泌
科學研究表明跑步可以刺激大腦分泌內生性大麻素,進而讓人產生較為強烈的快感。研究證實奔跑帶來快感的現象也存在於其他動物身上,但並不是所有動物。萊切勒假設內生性大麻素帶來運動快感這種現象也存在於憑藉較快奔跑速度獲得進化益處的哺乳動物身上,例如羚羊、馬和狼。但在以敏捷靈巧而不是奔跑速度著稱的動物——例如雪貂——身上,則不存在這種現象。
合成酶系統
anandamide和2-AG是通過不同的通路合成的。anandamide是由一種磷脂前體-nape的裂解物構成的。這種前體是由N-醯基轉移酶(NAT)合成的,它催化了花生四烯酸從磷酸卵磷脂向腦磷脂首基的轉移。Anandamide從NAPE中分離出來的反應是由一種特殊的磷脂酶D(PLD)催化的。由於2-AG屬於甘油一酯,它的合成和釋放與anandamide不同。它的合成是通過受體依賴的磷脂醯肌醇特異性磷脂酶C的激活,並與三醯基甘油的代謝密切相關的。與PLC和甘油二酯(DG)脂肪酶相偶聯的促代謝受體的激活能夠增加2-AG的合成。
降解酶系統
內源性大麻素的降解是由兩個特殊的酶系統所完成的:脂肪醯胺水解酶(FAAH)和單醯基甘油酯酶(MAGL)。FAAH是一種屬於絲氨酸水解酶家族的膜酶,廣泛分布於機體的各個部位,在大腦和肝臟中的濃度較高。FAAH能夠降解多種脂肪醯胺,如anandamide和睡眠因子油醯胺。儘管FAAH能夠使2-AG失活,但是起主要作用的是MAGL。MAGL也是一種絲氨酸水解酶,它分布於特定腦神經元的神經末梢中。
保護神經系統機制
在神經系統中,大麻素系統能夠決定神經元的存活與死亡。體內和體外實驗都已經證實,當神經元受到損傷,如興奮性中毒、外傷性腦損傷、腦缺血時,大麻素能夠起到保護作用。
研究表明,這些神經保護作用可能依賴於不同的機制,包括:
①減少細胞鈣內流,抑制谷氨酸能神經遞質。研究報導大麻素受體的激活降低了神經母細胞瘤-神經膠質瘤細胞系電壓門控通道鈣離子電流的幅度。這種N型鈣離子通道的抑制能夠降低包括谷氨酸在內的神經遞質的釋放。還有研究報導人工合成或天然的CB1受體激動劑都能夠阻斷突觸前谷氨酸的釋放。這種作用能夠被CB1受體拮抗劑所阻斷。此外,WIN55212-2和CP55940可以通過啟動時間和劑量依賴的腺苷酸環化酶抑制,降低細胞內鈣離子濃度,從而減少海馬細胞的死亡。
②抗氧化,抑制自由基形成。植物來源的大麻素和一些人工合成的類似化合物都是含酚的化學物質,因此,這種特有的化學結構使它具有固有的不依賴於大麻素受體的抗氧化作用。第一個表現出抗氧化活性的大麻素是HU21143,它具有與維生素E和維生素C相似的氧化電位。
③誘導低溫狀態的產生,如HU210,WIN55212-2等。研究顯示,△9-THC是通過CB1受體,誘導低體溫而產生作用的,當使用SR141716抑制CB1受體、升高體溫時,則△9-THC的作用被抑制;而cannabidiol則是通過非CB1受體、非低體溫依賴機制產生保護作用。但並不是所有的大麻素受體激動劑都能誘導產生低體溫。
④抗炎作用。大麻素能夠抑制TNFα的釋放。研究表明,原代培養的鼠皮層小神經膠質細胞暴露於LPS時,能夠顯著地激活TNF-αmRNA的表達與釋放。而內源性大麻素anandamide和2-AG,以及人工合成的大麻素類激動劑R(+)WIN55212-2,CP55940和HU210能夠通過濃度依賴性途徑抑制LPS誘導的TNF-α釋放。anandamide還能夠抑制星形膠質細胞中內毒素誘導的NO和TNF-α的釋放。
⑤神經細胞發育的調節。
大麻素能夠調節不同類型神經細胞的死亡與存活。靶細胞自身性質及其所處增殖/分化階段的不同將導致不同的結果。大麻素能夠對初級神經元、星形膠質細胞、少突膠質細胞產生保護作用而抑制其凋亡,但卻能夠攻擊轉化膠質細胞而使之易於凋亡。此外,內源性大麻素系統對於神經發生和神經元分化也具有潛在作用。最近的研究表明,內源性大麻素能夠刺激成熟大腦神經前體細胞增殖並抑制海馬神經發生。大麻素能夠抑制皮質神經元分化並促進神經膠質細胞的分化。從另一方面來看,大麻素也能夠調節軸突生長和突觸發生。這些實驗結果表明內源性大麻素組成了一個負責神經前體細胞增殖和分化的脂質信號家族,它通過作用於CB1受體產生有益的增殖信號。
⑥細胞外信號調節激酶的激活。
研究顯示,大麻素受體激動劑WIN55212-2通過作用於Gi/o蛋白激活細胞外信號調節激酶(ERK)。在這一過程中,包括PI3-激酶、Src和蛋白質磷酸酶在內的許多通路都對ERK的激活起到了促進的作用。ERK能夠調節轉錄、翻譯、突觸囊泡融合和細胞骨架動力學。研究發現,紋狀體和海馬區CB1受體的興奮將激活ERK並導致其下游轉錄因子的磷酸化。這些信號通路的激活能夠對細胞產生保護作用,如由CB1受體介導的急性ERK和PI3K/PKB的激活能夠保護神經膠質細胞,抑制神經醯胺誘導產生的細胞凋亡。但是從另一方面來看,由於CB1受體的激活能夠誘導神經醯胺持續增加和ERK的持續激活,因此它同樣能夠促進細胞凋亡,尤其是轉化細胞的凋亡。研究證實,當ERK通路持續被激活時,將產生生長抑制和毒性作用。例如,對於神經膠質細胞而言,CE1受體誘導的ERK激活的強度和動力學的不同將對細胞產生完全相反的結果。ERK的短期激活將保護神經膠質細胞不發生凋亡;持續的ERK激活將促進凋亡和生長抑制。
⑦微血管系統的控制。
研究表明,2-AG是一個有效的血管緊張度調節劑,它能夠對由內皮素(ET-1)所誘導的加重腦損傷的血管收縮產生抑制作用。
⑧抑制誘生型一氧化碳合酶的表達。
研究表明,氧糖剝奪(OGD)能夠增加iNOS的表達。許多不同的機制參與了iNOS的誘導,如TNF-α及谷氨酸的釋放。iNOS的激活引起了大量NO的產生,是導致缺氧性腦損傷的主要因素。WIN能夠通過增加IL-1ra釋放或抑制NF-κB的轉錄活動抑制膠質細胞中OGD誘導的iNOS的產生。
雙重作用
動物實驗發現,長期給與大麻素藥物將導致持久的認知功能缺陷。長期給予大麻素的老鼠,其海馬的形態學發生了改變,包括神經元死亡、突觸密度減少和錐體細胞樹突長度的減少。這表明,長期給予大麻素將產生神經毒性作用。此外,THC對於培養海馬神經元、神經膠質瘤細胞、皮質神經元細胞都具有毒性作用,並能抑制活體內神經膠質瘤細胞的生長。
為此,研究者提出了一些能夠解釋大麻素神經毒性作用的機制:①caspases的激活;②神經醯胺的蓄積;③不同MAPK路徑的激活。有研究表明,THC誘導的原代老鼠皮層神經元凋亡依賴於JNK級聯反應。
綜上所述,大麻素能夠導致神經元生存或死亡這兩種相反的結果。我們可以想像是不同的試驗因素導致了這種雙重作用。為此,研究者們提出了以下幾種假設:①活體內給予低劑量的大麻素將產生神經毒性作用,而高劑量則產生保護作用;②低濃度的大麻素將產生神經毒性作用,而高濃度將保護神經元免受損傷;③長期給予大麻素將誘導神經元死亡,而急性給予則產生腦保護作用。
