卵磷脂型DHA DHA,學名二十二碳六烯酸,是一種對人體非常重要的多不飽和脂肪酸,屬於Omega-3不飽和脂肪酸家族中的重要成員。DHA是神經系統細胞生長及維持的一種主要元素,是大腦和視網膜的重要構成成分,是腦細胞增殖和大腦溝回形成及視網膜發育必須的物質,因此被稱為“腦黃金”,在人體大腦皮層中含量高達20%,在眼睛視網膜中約占50%,因此,對胎嬰兒智力和視力發育至關重要。DHA人體自身不能合成,只能靠外源補充。
DHA的分類
DHA從存在形態上分為:甘油三酯型、甲酯型、乙酯型和卵磷脂型;從來源上分為:魚油DHA、藻油DHA和蛋黃DHA。來源於魚油、藻油的DHA為甘油三酯型、甲酯型和乙酯型,來源於蛋黃的DHA為卵磷脂型。乙酯型(ethylesters,EE)
甘油三酯型(triacylglycerides,TG)
卵磷脂型DHA(PhosphatidylcholineDHA,PC-DHA)
DHA的存在形態
早期研究表明,DHA在自然界通常是以甘油三酯形態存在的。海洋魚類,某些海藻或低等真菌是DHA的重要來源。以魚油DHA為例,魚體內含有的DHA是以甘油三酯形態存在,但含量較低,通常在5%~14%。人類為了獲取DHA進行了長期的科學研究和實驗。早期市場上的DHA是通過有機溶劑從魚油或海藻中提取出來的,早期所採用的有機溶劑並沒有改變DHA的結構,因此,早期使用有機溶劑所提取的DHA均為天然形態存在的甘油三酯型DHA,但提取效率低下。為了提高提取效率,獲取更高含量和更多的DHA,人們先後發明採用了低溫分級法、溶劑提取法、尿素包合法、分子蒸餾法和超臨界氣體萃取法等方法。以溶劑提取法為例,將乙醇、魚油及氫氧化鈉(NaOH)按一定比例混合,然後加熱使魚油皂化。皂化後的混合液經壓濾分別得到皂液及皂粒。皂液在攪拌下加人硫酸(H2SO4),分離上層粗脂肪酸乙醇混合液,再加熱回收乙醇,並反覆水洗即得DHA含量較高的精製魚油。用這種方法提取DHA的效率顯著提高,但所得到的DHA不再是天然形態存在的甘油三酯型DHA,而是乙酯型DHA。目前市場上的DHA製品中有很大一部分為乙酯型DHA。
甘油三酯型DHA即DHA和甘油所形成的酯,其結構如下,甘油3個醇羥基的氫被DHA所取代;
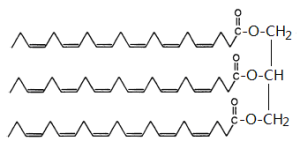 甘油三酯型DHA
甘油三酯型DHA同理,乙酯型DHA即DHA和乙醇所形成的酯,其結構如下,乙醇上醇羥基的氫被DHA所取代;
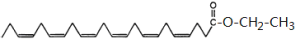 乙酯型DHA
乙酯型DHADHA存在形態對人體消化吸收的影響
DHA的結構差異或者說存在狀態對DHA在人體內的消化吸收會產生巨大影響。不管是乙酯型和甲酯型或者是甘油三酯型,在體內都是以被動擴散的方式被吸收的。乙酯型DHA吸收率僅為20%左右,天然形態存在的甘油三酯型DHA吸收率遠高於乙酯型,也只有50%左右。而近幾年科學研究發現,新一代卵磷脂型DHA在體內以主動吸收的方式被吸收,吸收率接近100%。 DHA來源、形態
DHA來源、形態科學研究的新發現----卵磷脂型DHA
卵磷脂型DHA的來源
卵磷脂型DHA只存在於蛋黃中,因此只能來源於蛋黃。而魚油DHA、藻油DHA不是甲酯型,就是乙酯型或甘油三酯型。卵磷脂型DHA的分子結構
卵磷脂Lecithin是一類含磷脂類物質,最早由Uauquelin於1812年從人腦中發現,Golbley於1844年從蛋黃中分離出卵磷脂(也稱為蛋黃素),並於1850年按照希臘文lekithos(蛋黃)命名為Lecithos。廣義的卵磷脂是各種磷脂的總稱,包括磷脂醯膽鹼(Phosphatidylcholine,PC)、磷脂醯乙醇胺(Phosphatidythanolamine,PE)、神經鞘磷脂(Sphingomyelin,SM)、肌醇磷脂(Phosphatidylinositol,PI)、溶血磷脂醯膽鹼(Lysophosphatidylcholine,LPC))磷脂醯絲氨酸(Phosphatidyserine,PS)等,狹義的卵磷脂是指磷脂醯膽鹼(PC)。科學家經過長期研究發現,雞蛋黃中卵磷脂主要為磷脂醯膽鹼(70%~75%)和磷脂醯乙醇胺(15%~20%),當卵磷脂成分中的R1,R2為DHA時即形成了卵磷脂型DHA。磷脂醯膽鹼和磷脂醯乙醇胺的結構式(R1,R2代表脂肪酸)如下:
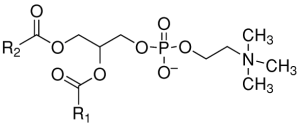 磷脂醯膽鹼
磷脂醯膽鹼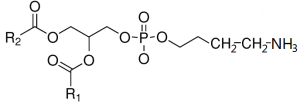 磷脂醯乙醇胺
磷脂醯乙醇胺新一代卵磷脂型DHA具備以下特點:
1、純天然目前市售的甲酯型和乙酯型DHA是通過分子蒸餾等方法把魚油或海藻中的DHA水解下來分離純化得到的,而蛋黃中含有的卵磷脂型DHA是雞吃了含有DHA或α-亞麻酸的飼料,在雞體內經過一系列消化吸收等生理反應自然形成的,具有純天然特性。至於雞為什麼會在體內轉化、吸收並特異性的積累形成卵磷脂型DHA還需要科學界進一步探索研究。
2、更容易被人體吸收
DHA存在形態不同,被人體吸收利用的效率差異很大。乙酯型DHA在人體內是以被動擴散的方式被吸收,吸收率僅為20%左右;甘油三酯型吸收率遠高於乙酯型,也只有50%左右。因為卵磷脂可促進脂肪酸代謝,因此蛋黃卵磷脂型DHA在人體內吸收方式為主動吸收,吸收率接近100%。
3、安全性高
眾所周知,蛋黃因為其營養豐富及安全性高是嬰幼兒添加輔食的第一選擇。蛋雞是“生物篩”,雞蛋形成過程中的禁止效能可將對嬰幼兒健康產生不利影響物質阻擋在雞蛋之外,因此蛋黃卵磷脂型DHA既不含對人體有升高膽固醇和破壞血管內膜作用的豆蔻酸、月桂酸等;也不存在被重金屬污染而超標問題,產品更安全,媽媽和寶寶的健康更有保障。
同時,從人體對各種DHA的消化吸收過程來看,甲酯型DHA在人體內分解為甲醇和DHA;乙酯型DHA分解為乙醇和DHA;卵磷脂型DHA分解為卵磷脂和DHA。甲醇具有毒性,乙醇對胚胎和嬰幼兒具有刺激性,而磷脂是很好的乳化劑,能促進乳糜微粒的形成,有助於提高乳糜的穩定性和運輸脂肪酸的能力。因此可以促進DHA的運輸能力,進而提高吸收率。磷脂的乳化能力具有與膽汁的協同作用,具有節約膽汁的作用,對於肝膽發育尚未完全的嬰幼兒具有更大價值。
4、營養豐富
蛋黃磷脂型DHA屬於動物胚胎磷脂,除了卵磷脂和DHA外,還富含人體所必須的其他營養素:蛋白質和多種微量元素(鈣、鐵、鋅、硒、鉀、鎂等)以及豐富的維生素E、B2、B12,還含有豐富的長鏈不飽和脂肪酸—油酸、亞油酸以及多種胺基酸,打破了單純補充DHA的模式,實現了生命所需營養的全方位補充,能對孕產婦和嬰幼兒進行全面營養補充。
5、穩定性好
卵磷脂和DHA緊密結合在一起,相比游離DHA更穩定,不易被氧化,保質期更長。
6、降低血液中膽固醇濃度,防止膽結石
體內過多的膽固醇會發生沉澱,從而形成膽結石,蛋黃卵磷脂型DHA中的卵磷脂可將膽固醇乳化為極細的顆粒,這種微細的乳化膽固醇顆粒可透過血管壁被組織利用,故具有降低血液中的膽固醇濃度及防止膽結石的作用。
7、產品氣味、滋味好
新一代蛋黃卵磷脂型DHA氣味芬芳,有淡淡的蛋香味,作為輔食添加在牛奶、麵條、粥等主食里,使主食的滋味、氣味更好,能夠增加食慾;即使直接用溫水沖服,也很容易被孕婦和嬰幼兒接受和喜愛。
附:
卵磷脂型DHA與普通乙酯型DHA對比表
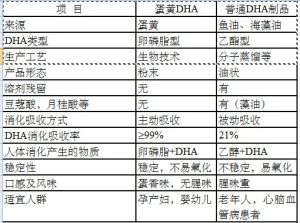 卵磷脂型DHA
卵磷脂型DHA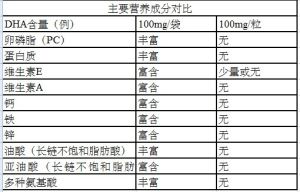 卵磷脂型DHA
卵磷脂型DHA卵磷脂型DHA的研究進展
卵磷脂型DHA只存在於蛋黃中,但由於含量極低,吃普通雞蛋無法起到補充卵磷脂型DHA的作用。目前,中國農業大學的科學家發明創新的複合植物提取物促進技術,採用純植物提取物,根據生物富集和轉化過程中各個階段的特點,經過反覆試驗,把純植物提取物進行科學配比,再與飼料充分發酵融合,充分釋放了純植物提取物的活性,使其在生物富集、轉化過程的各個階段發揮了強有力地促進作用,大大提高了富集率和轉化率,為人們提供更多更好更優質的卵磷脂型DHA創造了條件。卵磷脂+DHA是1+1>2
卵磷脂存在於人體所有的器官和細胞中,是構成細胞膜的主要成分,占細胞膜乾重的70—80%,並集中存在腦及神經系統,磷脂醯膽鹼因此被稱為“細胞膜的建築磚”。卵磷脂肩負著細胞的營養代謝、能量代謝、信息傳遞等功能,是生命和健康的必需物質,被譽為與蛋白質、維生素並列的“第三營養素”。牛奶、動物的腦、骨髓以及大豆和雞蛋等食物中都含有卵磷脂,其中蛋黃卵磷脂是營養成分最完整,營養價值最高的。卵磷脂的質量差異取決於所含活性成分的含量,其中最主要的活性成分即磷脂醯膽鹼和磷脂醯乙醇胺。
DHA是腦細胞增殖和大腦溝回形成所必須的重要構成成分的物質,但是僅有獨立的腦神經細胞,大腦仍不能夠正常思維,只有當各神經細胞間建立起信息傳遞的通道時,大腦才能具備思維的能力。信息傳遞的通道,就象一條條高速公路,高速公路的路面決定信息傳遞的速度,DHA促進了高速公路的延伸,保證高速公路四通八達;而高速公路的護欄,可確保信息傳遞的準確性,防止信息“上錯路”,卵磷脂不但是高速公路路面的物質前體,同時也是護欄的重要組成部分。DHA和卵磷脂二者緊密合作才能保證信息安全高速準確地到達目的地,二者對大腦的作用相輔相成,密不可分。因此,同時補充卵磷脂和DHA能起到事半功倍的效果,使得1+1>2。
參考文獻:
1. BeckermannB,BenekeM,SeitzI.(1990).Comparativebioavailabilityofeicosapentaenoicacidanddocosahexaenoicacidfromtriglycerides,freefattyacidsandethylestersinvolunteers.Arzneimittelforschung;40(6):700-704.
2. BestCA,LaposataM.(2003).Fattyacidethylesters:toxicnon-oxidativemetabolitesofethanolandmarkersofethanolintake.FrontBiosci;8:202-17.
3. Bondía-MartínezE,López-SabaterMC,Castellote-BargallóAI,Rodríguez-PalmeroM,González-CorbellaMJ,Rivero-UrgellM,Campoy-FolgosoC,Bayés-GarcíaR.(1998).Fattyacidcompositionofplasmaanderythrocytesinterminfantsfedhumanmilkandformulaewithandwithoutdocosahexaenoicandarachidonicacidsfromeggyolklecithin.EarlyHumDev.;53Suppl:S109-19.
4. CarlierH.,BernardA,CaseliA.(1991).Digestionandabsorptionofpolyunsaturatedfattyacids.ReprodNutrDev;31:475-500.
5. CarlsonSE,FordAJ,WerkmanSH,PeeplesJM,KooWW.(1996).Visualacuityandfattyacidstatusofterminfantsfedhumanmilkandformulaswithandwithoutdocosahexaenoateandarachidonatefromeggyolklecithin.PediatrRes;May;39(5):882-8.
6. DyerbergJ,MadsenP,MollerJM,AardestrupI,SchmidtEB.(2010).Bioavailabilityofmarinen-3fattyacidformations.ProstaglandinsLeutkot.Essent.FattyAcids83,137-141.
7. FaveG,CosteTCandArmandM.(2004).Physicochemicalpropertiesoflipids:Newstrategiestomanagefattyacidbioavailability.CellularandMolecularBiologyTM50(7),815-831.
8. HabberTS.,WilsonJS,MinotiVA,PirolaRC.(1991).Fattyacidethylestersincreaseratpancreaticlysosomalfragility.J.Lab.Clin.Med.121:75-764.
9. HansenJB,OlsenJO,WilsgårdL,LyngmoV,SvenssonB.(1993).Comparativeeffectsofprolongedintakeofhighlypurifiedfishoilsasethylesterortriglycerideonlipids,homeostasisandplateletfunctioninnormolipaemicmen.EurJClinNutr;,47:497-507.
10. HarrisWS,ZuckerML,DujovneCA.(1988).Omega-3fattyacidsinhypertriglyceridemicpatients:triglyceridesvsmethylesters.AmJClinNutr;48:992-997
11. IkedaI,SasakiE,YasunamiH,NomiyamaS,NakayamaM,SuganoM,ImaizumiK,YazawaK.(1995).Digestionandlymphatictransportofeicosapentaenoicanddocosahexaenoicacidsgivenintheformoftriacylglycerol,freeacidandethylesterinrats.BiochimBiophysActa;1259:297-304.
12. KrokanHE,BjerveKS,MørkE.(1993).Theenteralbioavailabilityofeicosapentaenoicacidanddocosahexaenoicacidisasgoodfromethylestersasfromglycerylestersinspiteoflowerhydrolyticratesbypancreaticlipaseinvitro.BiochimBiophysActa;1168:59-67.
13. LambertMS,BothamKM,MayesPA.(1997).Modificationofthefattyacidcompositionofdietaryoilsandfatsonincorporationintochylomicronsandchylomicronremnants.BrJNutr.;76:435-45
14. Lange,L.G.,andB.E.Sobel.(1983).Mitochondrialdysfunctioninducedbyfattyacidethylesters,myocardialmetabolitesofethanol.J.CZin.Invest.72:724-731,1983.
15. LawsonLD,HughesBG.(1988).Humanabsorptionoffishoilfattyacidsastriacylglycerols,freeacids,orethylesters.BiochemBiophysResCommun,52,328-335.
16. MogelsonS,PieperSJ,LangeLG.(1984).Thermodynamicbasesforfattyacidethylestersynthasecatalyzedesterificationoffreefattyacidwithethanolandaccumulationoffattyacidethylesters.Biochemistry.1984Aug28;23(18):4082-7.
17. NeubronnerJ,SchuchardtJP,KresselG,MerkelM,SchackyCandHahnA.Enhancedincreaseofomega-3indexinresponsetolongtermn-3fattyacidsupplementationfromtriacylglyceridesversusethylesters.Eur.J.ofClin.Nutr.(2010),1-8.
18. NordøyA,BarstadL,ConnorWE,HatcherL.(1991).Absorptionofthen-3eicosapentaenoicanddocosahexaenoicacidsasethylestersandtriglyceridesbyhumans.AmJClinNutr53:1185-90.
19. SaghirM,WernerJ,LaposataM.(1997).Rapidinvivohydrolysisoffattyacidethylesters,toxicnonoxidativeethanolmetabolites.AmJPhysiol.;273:G184-90.
20. SongJH,InoueY,MiyazawaT.(1997).Oxidativestabilityofdocosahexaenoicacid-containingoilsintheformofphospholipids,triacylglycerols,andethylesters.BiosciBiotechnolBiochem.61(12):2085-8
21. Szczepiorkowski,Z.RI.,G.R.Dickersin,andM.Laposata.(1995)Fattyacidethylestersdecreasehumanhepatoblastomacellproliferationandproteinsynthesis.GastroenteroZogy108:515-522.
22. VisioliF,RiseP,BarassiMC,MarangoniF,GalliC.(2003).Dietaryintakeoffishvs.formulationsleadstohigherplasmaconcentrationsofn-3fattyacids.Lipids;38:415-418.
23. ValenzuelaA,ValenzuelaV,SanhuezaJ,NietoS.(2005).Effectofsupplementationwithdocosahexaenoicacidethylesterandsn-2docosahexaenylmonoacylglycerideonplasmaanderythrocytefattyacidsinrats.AnnNutrMetab;49:49-53.
24. WernerJ,LaposataM,Fernandez-delCastilloC,SaghirM,IozzoRV,LewandrowskiKB,WarshawAL.(1997).Pancreaticinjuryinratsinducedbyfattyacidethylester,anonoxidativemetaboliteofalcohol.Gastroenterology;113:286–94.
25. YangLY,KuksisA,MyherJJ.(1990).Lipolysisofmenhadenoiltriacylglycerolsandthecorrespondingfattyacidalkylestersbypancreaticlipaseinvitro:areexamination.JLipidRes.31(1):137-47.
26. YangLY,KukisA,MyherJJ.(1990).Intestinalabsorptionofmenhadenandrapeseedandtheirfattyacidmethylandethylestersintherat.BiochemCellBiol.;68:480-91
27. 曹萬新,孟橘,田玉霞。DHA的生理功能及套用研究進展,中國油脂,2011,36(3)
28. 常皓,王二雷,宮新統,劉靜波。蛋黃卵磷脂研究概況,食品工業科技,2010,5
29. 丁慧萍,李艷紅,丁倩,張福東,王濤,王俐,蔡美琴。藻油及魚油二十二碳六烯酸複方製劑對兒童記憶功能的影響,中華臨床營養雜誌,2011,19(2)
30. 傅利軍,趙蔚蔚。蛋黃來源卵磷脂的套用及進展,食品安全導刊。2011,12
31. 宮新統,林松毅,劉靜波,李丹,黃金枝。HPLC在高純度蛋黃卵磷脂提取技術中的套用研究。食品科學,2008,12
32. 古紹彬,虞龍,向砥,于洋,余增亮。利用海洋微藻生產DHA和EPA的研究現狀及前景。中國水產科學,2001,8(3)
33. 郝穎,汪之和。EPA、DHA的營養功能及其產品安全性分析。現代食品科技,2006,22(3)
34. 郝穎,汪之和。EPA、DHA的營養功能及其產品安全性分析。現代食品科技,2006,22(3)
35. 李揚。高純度蛋黃卵磷脂製備工藝的研究。吉林大學,2007
36. 梁井瑞,胡耀池,陳園力,蔣露,張紅漫。分子蒸餾法純化DHA藻油。中國油脂,2012,37(6)
37. 劉偉民,馬海樂,李國文。魚油生理活性物質EPA和DHA分離進展。食品科學,2002,23(10)
38. 劉艷,豐利芳,唐慶,徐三清,羅小平。孕期補充DHA對脂多糖所致宮內感染仔鼠腦組織TLR4表達的影響。華中科技大學學報(醫學版),2011,40(4)
39. 孟麗萍,張堅,趙文華。母親DHA攝入與胎兒、嬰兒DHA營養狀況及發育的關係。衛生研究,2005,34(2)
40. 彭雲,李汴生,林應勝,黃巍峰,張影霞。微藻DHA在蛋糕中的套用。現代食品科技,2012,28(2)
41. 任國譜,黃興旺,岳紅,肖蓮榮,申衍豪。嬰幼兒配方奶粉中二十二碳六烯酸(DHA)的氧化穩定性研究。中國乳品工業,2011,39(1)
42. 阮征,吳謀成,胡筱波,薛照輝。多不飽和脂肪酸的研究進展。中國油脂,2003,28(2)
43. 譚利偉,麻麗坤,趙進,尹兆正。蛋黃卵磷脂的套用研究進展。中國家禽,2005,21
44. 田冰,劉亞軍,劉繼明。高效快速提取蛋黃卵磷脂的新方法。食品科技,2000,2
45. 王衛飛,馬永鈞,范海星,王永華,楊博。酶法合成富含DHA、EPA甘油三酯的研究。中國油脂,2011,36(2)
46. 吳克剛,孟宏昌。嬰幼兒配方奶粉強化DHA和AA的研究。中國乳品工業,2004,32(2)
47. 張娟梅,柯崇榕,黃建忠。DHA單細胞油脂的萃取與濃縮。中國油脂,2008,33(10)
48. 丁宗一,杜麗蓉。不同餵養方法對嬰幼兒生長速率影響的研究。中華兒科雜誌,2002,40(11)
49. 張義明。DHA的來源及合理套用。食品工業科技,2003,24(8)
50. 周遠揚,雷百戰,潘藝。魚油EPA與DHA提取方法研究進展。廣東農業科學,2009,(12)
51. 周冉,王飛,常明,岳紅坤,史蘭香,劉司婕。從微藻中提取分離EPA和DHA的方法。安徽農業科學,2012,40(14)
52. 朱路英,張學成,宋曉金,況成宏,孫遠征。n-3多不飽和脂肪酸DHA、EPA研究進展。海洋科學,2007,31(11)

