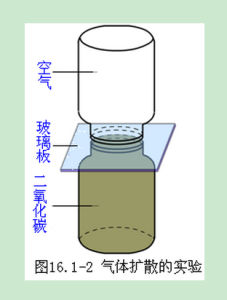
擴散現象
不同物質能夠彼此進入對方,物理學把這類現象叫做擴散(diffusion)。擴散現象並不是外界作用(例如對流、重力作用等)引起的,也不是化學反應的結果,而是由物質分子的無規則運動產生的。如:把金片和鉛片壓在一起,不管金片放在上面還是下面金都會擴散到鉛中,鉛也會擴散到金中。擴散運動是物質分子永不停息的做無規則運動的證明。
擴散現象在科學技術中有很多套用。生產半導體器件時,需要在純淨半導體材料中摻入其他元素這就是在高溫條件下通過分子的擴散來完成的。
布朗運動
19世紀中對布朗運動的研究
布朗的發現是一個新奇的現象,它的原因是什麼?人們是迷惑不解的。在布朗之後,這一問題一再被提出,為此有許多學者進行過長期的研究。一些早期的研究者簡單地把它歸結為熱或電等外界因素引起的。最早隱約指向合理解釋的是維納(1826——1896),1863年他提出布朗運動起源於分子的振動,他還公布了首次對微粒速度與粒度關係的觀察結果。不過他的分子模型還不是現代的模型,他看到的實際上是微粒的位移,並不是振動。在維納之後,S·埃克斯納也測定了微粒的移動速度。他提出布朗運動是由於微觀範圍的流動造成的,他沒有說明這種流動的根源,但他看到在加熱和光照使液體粘度降低時,微粒的運動加劇了。就這樣,維納和S·埃克斯納都把布朗運動歸結為物系自身的性質。這一時期還有康托尼,他試圖在熱力理論的基礎上解釋布朗運動,認為微粒可以看成是巨大分子,它們與液體介質處於熱平衡,它們與液體的相對運動起源於滲透作用和它們與周圍液體之間的相互作用。
70-80年代
到了70——80年代,一些學者明確地把布朗運動歸結為液體分子撞擊微粒的結果,這些學者有卡蓬內爾、德爾索和梯瑞昂,還有耐格里。植物學家耐格里(1879)從真菌、細菌等通過空氣傳播的現象,認為這些微粒即使在靜止的空氣中也可以不沉。聯繫到物理學中氣體分子以很高速度向各方向運動的結論,他推測在陽光下看到的飛舞的塵埃是氣體分子從各方向撞擊的結果。他說:“這些微小塵埃就象彈性球一樣被擲來擲去,結果如同分子本身一樣能保持長久的懸浮。”不過耐格里又放棄了這一可能達到正確解釋的途徑,他計算了單個氣體分子和塵埃微粒發生彈性碰撞時微粒的速度,結果要比實際觀察到的小許多數量級,於是他認為由於氣體分子運動的無規則性,它們共同作用的結果不能使微粒達到觀察速度值,而在液體中則由於介質和微粒的摩擦阻力和分子間的粘附力,分子運動的構想不能成為合適的解釋。1874——1880年間,卡蓬內爾、德耳索和梯瑞昂的工作解決了耐格里遇到的難題。這裡的關鍵是他們認為由於分子運動的無規則性和分子速度有一分布,在液體或氣體中的微觀尺度上存在密度和壓力的漲落。這種漲落在巨觀尺度上抵消掉了。但是如果壓方面足夠微小,這種不均勻性就不能抵消,液體中的相應的擾動就能表現出來。因此懸浮在液體中的微粒只要足夠小,就會不停地振盪下去。卡蓬內爾明確地指出唯一影響此效應的因素是微粒的大小,不過他把這種運動主要看成振盪,而德耳索根據克勞修斯把分子運動歸結為平動和轉動的觀點,認為微粒的運動是無規則位移,這是德耳索的主要貢獻。
此後,古伊在1888——1895年期間對布朗運動進行過大量的實驗觀察。古伊對分子行為的描述並不比卡蓬內爾等人高明,他也沒有弄清漲落的見解。不過他的特別之處是他強調的不是對布朗運動的物理解釋,而是把布朗運動作為探究分子運動性質的一個工具。他說:“布朗運動表明,並不是分子的運動,而是從分子運動導出的一些結果能向我們提供直接的和可見的證據,說明對熱本質假設的正確性。按照這樣的觀點,這一現象的研究承擔了對分子物理學的重要作用。”古伊的文獻產生過重要的影響,所以後來貝蘭把布朗運動正確解釋的來源歸功於古伊。
到了1900年,F·埃克斯納完成了布朗運動前期研究的最後工作。他用了許多懸濁液進行了和他的父親S·埃克斯納30年前作過的同類研究。他測定了微粒在1min內的位移,與前人一樣,證實了微粒的速度隨粒度增大而降低,隨溫度升高而增加。他清楚地認識到微粒作為巨大分子加入了液體分子的熱運動,指出從這一觀點出發“就可以得出微粒的動能和溫度之間的關係。”他說:“這種可見的運動及其測定值對我們清楚了解液體內部的運動會有進一步的價值”。
以上是1900年前對布朗運動研究的基本情況。自然,這些研究與分子運動論的建立是密切相關的。由麥克斯威和玻爾茲曼在60——70年代建立的氣體分子運動論在概念上的一個重大發展是拋棄了對單個分子進行詳細跟蹤的方法,而代之以對大量分子的統計處理,這為弄清布朗運動的根源打下了基礎。與布朗運動的研究有密切關係的還有在60年代由格雷哈姆建立的膠體科學。所謂膠體是由粒度介於巨觀粒子和微觀分子之間的微粒形成的分散體系,布朗運動正是膠體粒子在液體介質中表現的運動。
對於布朗運動的研究,1900年是個重要的分界線。至此,布朗運動的適當的物理模型已經顯明,剩下的問題是需要作出定量的理論描述了。
愛因斯坦的布朗運動理論
1905年,愛因斯坦依據分子運動論的原理提出了布朗運動的理論。就在差不多同時,斯莫盧霍夫斯基也作出了同樣的成果。他們的理論圓滿地回答了布朗運動的本質問題。應該指出,愛因斯坦從事這一工作的歷史背景是那時科學界關於分子真實性的爭論。這種爭論由來已久,從原子分子理論產生以來就一直存在。本世紀初,以物理學家和哲學家馬赫和化學家奧斯特瓦爾德為代表的一些人再次提出對原子分子理論的非難,他們從實證論或唯能論的觀點出發,懷疑原子和分子的真實性,使得這一爭論成為科學前沿中的一個中心問題。要回答這一問題,除開哲學上的分歧之外,就科學本身來說,就需要提出更有力的證據,證明原子、分子的真實存在。比如以往測定的相對原子質量和相對分子質量只是質量的相對比較值,如果它們是真實存在的,就能夠而且也必須測得相對原子質量和相對分子質量的絕對值,這類問題需要人們回答。
由於上述情況,象愛因斯坦在論文中指出的那樣,他的目的是“要找到能證實確實存在有一定大小的原子的最有說服力的事實。”他說:“按照熱的分子運動論,由於熱的分子運動,大小可以用顯微鏡看見的物體懸浮在液體中,必定會發生其大小可以用顯微鏡容易觀測到的運動。可能這裡所討論的運動就是所謂‘布朗分子運動’”。他認為只要能實際觀測到這種運動和預期的規律性,“精確測定原子的實際大小就成為可能了”。“反之,要是關於這種運動的預言證明是不正確的,那么就提供了一個有份量的證據來反對熱的分子運動觀”。
愛因斯坦的成果大體上可分兩方面。一是根據分子熱運動原理推導,是在t時間裡,微粒在某一方向上位移的統計平均值,即方均根值,D是微粒的擴散係數。這一公式是看來毫無規則的布朗運動服從分子熱運動規律的必然結果。
愛因斯坦成果的第二個方面是對於球形微粒,推導出了可以求算阿式中的η是介質粘度,a是微粒半徑,R是氣體常數,NA為阿伏加德羅常數。按此公式,只要實際測得準確的擴散係數D或布朗運動均方位得到原子和分子的絕對質量。愛因斯坦曾用前人測定的糖在水中的擴散係數,估算的NA值為3.3×10^23,一年後(1906)又修改為6.56×10^23。
愛因斯坦的理論成果為證實分子的真實性找到了一種方法,同時也圓滿地闡明了布朗運動的根源及其規律性。下面的工作就是要用充足的實驗來檢驗這一理論的可靠性。愛因斯坦說:“我不想在這裡把可供我使用的那些稀少的實驗資料去同這理論的結果進行比較,而把它讓給實驗方面掌握這一問題的那些人去做”。“但願有一位研究者能夠立即成功地解決這裡所提出的、對熱理論關係重大的這個問題!”愛因斯坦提出的這一任務不久之後就由貝蘭(1870——1942)和斯維德伯格分別出色的完成了。這裡還應該提到本世紀初在研究布朗運動方面一個重大的實驗進展是1902年齊格蒙第(1865——1929)發明了超顯微鏡,用它可直接看到和測定膠體粒子的布朗運動,這也就是證實了膠體粒子的真實性,為此,齊格蒙第曾獲1925年諾貝爾化學獎。斯維德伯格測定布朗運動就是用超顯微鏡進行的。
貝蘭測定阿伏加德羅常數的實驗
1908到1913年期間,貝蘭進行了驗證愛因斯坦理論和測定阿伏加德羅常數的實驗研究。他的工作包括好幾方面。在初期,他的想法是,既然在液體中進行布朗運動的微粒可以看成是進行熱運動的巨大分子,它們就應該遵循分子運動的規律,因此只要找到微粒的一種可用實驗觀測的性質,這種性質與氣體定律在邏輯上是等效的,就可以用來測定阿伏加德羅常數。1908年,他想到液體中的懸浮微粒相當於“可見分子的微型大氣”,所以微粒濃度(單位體積中的數目)的高度分布公式應與氣壓方程有相同的形式,只是對粒子受到的浮力應加以校正。這一公式是:ln(n/n0)=-mgh(1-ρ/ρ0)/kt。式中k是波爾茲曼常數,自k和NA的關係,公式也可寫成ln(n/n0)=-NAmgh(1-ρ/ρ0)/RT。根據此公式,從實驗測定的粒子濃度的高度分布數據就可以計算k和NA。為進行這種實驗,先要製得合用的微粒。製備方法是先向樹脂的酒精溶液中加入大量水,則樹脂析出成各種尺寸的小球,然後用沉降分離的方法多次分級,就可以得到大小均勻的級份(例如直徑約3/4μm的藤黃球)。用一些精細的方法測定小球的直徑和密度。下一步是測定懸浮液中小球的高度分布,是將懸浮液裝在透明和密閉的盤中,用顯微鏡觀察,待沉降達到平衡後,測定不同高度上的粒子濃度。可以用快速照相,然後計數。測得高度分布數據,即可計算NA。貝蘭及其同事改變各種實驗條件:材料(藤黃、乳香),粒子質量(從1到50),密度(1.20到1.06),介質(水,濃糖水,甘油)和溫度(-90°到60°),得到的NA值是6.8×1023。
貝蘭的另一種實驗是測量布朗運動,可以說這是對分子熱運動理論的更直接證明。根據前述的愛因斯坦對球形粒子導出的公式,只要實驗液,在選定的一段時間內用顯微鏡觀察粒子的水平投影,測得許多位移數值,再進行統計平均。貝蘭改變各種實驗條件,得到的NA值是(5.5-7.2)×1023。貝蘭還用過一些其它方法,用各種方法得到的NA值是:
6.5×1023用類似氣體懸浮液分布法,
6.2×1023用類似液體懸浮液分布法,
6.0×1023測定濃懸浮液中的騷動,
6.5×1023測定平動布朗運動,
6.5×1023測定轉動布朗運動。
這些結果相當一致,都接近現代公認的數值6.022×1023。考慮到方法涉及許多物理假設和實驗技術上的困難,可以說這是相當了不起的。以後的許多研究者根據其它原理測定的NA值都肯定了貝蘭結果的正確性。與貝蘭差不多同時,斯維德伯格(1907)用超顯微鏡觀測金溶膠的布朗運動,在測定阿伏加德羅常數和驗證愛因斯坦理論上也作出了出色的工作。可以說他們是最先稱得原子質量的人,所以在1926年,貝蘭和斯維德伯格分別獲得了諾貝爾物理學獎和化學獎。
就這樣,布朗運動自發現之後,經過多半個世紀的研究,人們逐漸接近對它的正確認識。到本世紀初,先是愛因斯坦和斯莫盧霍夫斯基的理論,然後是貝蘭和斯維德伯格的實驗使這一重大的科學問題得到圓滿地解決,並首次測定了阿伏加德羅常數,這也就是為分子的真實存在提供了一個直觀的、令人信服的證據,這對基礎科學和哲學有著巨大的意義。從這以後,科學上關於原子和分子真實性的爭論即告終結。正如原先原子論的主要反對者奧斯特瓦爾德所說:“布朗運動和動力學假說的一致,已經被貝蘭十分圓滿地證實了,這就使那怕最挑剔的科學家也得承認這是充滿空間的物質的原子構成的一個實驗證據”。數學家和物理學家彭加勒在1913年總結性地說道:“貝蘭對原子數目的光輝測定完成了原子論的勝利”。“化學家的原子論現在是一個真實存在”。
布朗運動代表了一種隨機漲落現象,它的理論在其他領域也有重要套用。如對測量儀器的精度限度的研究;高倍放大電訊電路中的背景噪聲的研究等。
布朗運動與分子熱運動不一樣,與溫度和粒子個數有關,溫度越高,布朗運動越劇烈,粒子越少,分子熱運動越劇烈。
分子熱運動
在擴散運動中我們會發現,溫度越高,擴散的越快。觀察布朗運動時也會發現,溫度越高,懸浮微粒的運動就越明顯。這些事態 :表明分子的無規則運動與溫度有關係,溫度越高這種運動就越激烈。因此我們把分子永不停息的無規則運動叫做熱運動(thermalmotion)舉一個簡單的例子,你用一條金片和一條鉛片貼合在一起,在常溫下放置5年,再切開,你會發現他們互相滲入有1mm深,如果持續加100°C的熱,他們會貼合得更快。
分子熱運動的聯繫
分子的運動與溫度和分子質量有關,但如果想真正了解它,只能在電子顯微鏡下看到。分子的運動還與分子的間隔有關,比如說,在常溫下,氣體與氣體之間的運動會很快,要觀察其運動現象,最多只需1天;而液體需要1個月左右;而固體需幾年。並且我們會發現在分子的間隙上看:氣體大於液體大於固體(分子間隙),因此,分子的運動與分子的間隔有關。在一個燒杯中裝半杯熱水,另一個同樣的燒杯中裝等量的涼水。用滴管分別在兩個杯底注入一滴墨水,發現裝熱水的燒杯的顏色變化地快。說明分子的熱運動與溫度有關。分子熱運動可以在氣體、液體和固體間進行。