分子動理論的公式
設阿伏伽德羅常數為 N,物體體積為 V,質量為 m,密度為 ρ,摩爾體積為 V,摩爾質量為 M,分子體積為 V,分子質量為 m,分子數為 n。
(1)分子的質量 m= M / N= V ρ / N
(2)分子數 n= mN / M= VN / V= Vρ N / M= mN/ ρV
(3)固體、液體分子體積 V和直徑 d
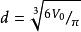 分子動理論
分子動理論V= V/ N= M / ρN=1/6π d ,.
氣體分子動理論
人們從分子運動的微觀模型出發,給出某些簡化的假定,結合機率論和統計力學的知識,提出了氣體分子動理論(kinetic theory of gases),其主要如下:
(1)氣體是由分子組成的,分子是很小的粒子,彼此間的距離比分子的直徑(10 m)大許多,分子體積與氣體體積相比可以略而不計。
(2)氣體分子以不同的速度在各個方向上處於永恆的無規則運動之中。典型事例是擴散現象、布朗運動(均為間接體現)。布朗運動表面體現了巨觀微粒的無規則運動,實際反映出微觀分子的無規則運動。
(3)除了在相互碰撞時,氣體分子間相互作用是很微弱的,甚至是可以忽略的。
(4)氣體分子相互碰撞或對器壁的碰撞都是彈性碰撞。
(5)分子的平均動能與熱力學溫度成正比。
(6)分子間同時存在著相互作用力。分子間同時存在著引力和斥力,引力和斥力都隨分子間距離的增大而減小(分子間距越大,引力和斥力都越小;分子間距越小,引力和斥力都越大)。但斥力的變化比引力快,實際表現出來的是引力和斥力的合力。合力在0~ r時表現為斥力,在 r~∞時表現為引力( r為引力等於斥力的臨界點)。