概述
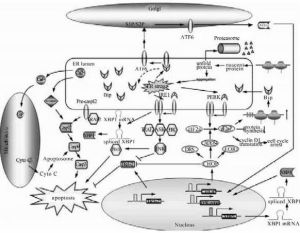
內質網內環境的穩定是實現內質網功能的基本條件,因此內質網具有極強的內穩態體系.但仍然有很多因素可導致內質網功能的內穩態失衡,形成內質網應激。例如缺血再灌注損傷、氧化應激、同型半胱氨酸等化學物質處理、細胞內蛋白質合成過快以至於超過蛋白摺疊能力、內質網鈣代謝紊亂、卵磷脂合成障礙等多種物理、化學或遺傳因素等均可引發內質網應激。內質網是真核細胞中蛋白質合成、摺疊與分泌的重要細胞器。細胞進化出一套完整的機制來監督和幫助內質網內蛋白質的摺疊與修飾.而當錯誤摺疊的蛋白質累積時,細胞通過一系列信號轉導途徑,對其進行應答,包括增強蛋白質摺疊能力、停滯大多數蛋白質的翻譯、加速蛋白質的降解等。如果內質網功能紊亂持續,細胞將最終啟動caspase12依賴的細胞凋亡程式.這些反應被統稱為未摺疊蛋白質應答(unfoldedproteinresponse,UPR)
其他
 內質網應激
內質網應激細胞ER因素
ER含有大量的伴侶蛋白、糖基化酶以及氧化還原酶為新生膚鏈的摺疊提供了最佳化的環境,同時ER質量控制系統(ERqualityeontrolsystem)能通.過ER相關降解作用(ERassoeiateddegradationERAD)降解非正確摺疊的中間產物,凡影晌ER功能的因素都能夠引起ERstress,包括有下列各種因素:1.細胞營養物質缺乏包括葡萄糖飢餓和胺基酸飢餓,蛋白質及核昔酸的生物合成均需要必要的營養物質,所以葡萄糖飢餓和胺基酸飢餓代表一種代謝壓力。
2.影響蛋白質翻譯後修飾的因素,如還原物質二琉基蘇糖醇(DTT)、β琉基乙醇(β-ME)、同型半朧氨酸(homoeystine);糖基化抑制劑衣黴素(tunieamyein)、葡萄糖胺(glueosamine)、2-脫氧葡萄糖(2-deoxyglueose)等。
3.影響ER鈣離子平衡的藥物,如ERCa2+酶抑制劑Thapsigagrin,鈣離子載體A23187,鈣離子鰲合劑EGTA,抗生素lonomycin等。
4.突變基因表達的結構異常蛋白在ER堆積。
5.其它一些有害因素如細胞病毒感染等。
信號通路
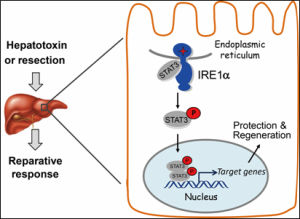
Irel通路
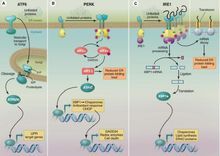 非摺疊蛋白反應主要的三條通路
非摺疊蛋白反應主要的三條通路