歷史
一氧化二氮是約瑟夫·普利斯特里在1772年發現的,漢弗萊·戴維自己和他的朋友,包括詩人柯爾律治和羅伯特·騷塞在16世紀90年代試驗了這種氣體。他們發現一氧化二氮能使病人喪失痛覺,而且吸入後仍然可以保持意識,不會神志不清。不久後笑氣就被當作麻醉劑使用,尤其在牙醫師領域。因為通常牙醫師無專職的麻醉師,而診療過程中常需要病患保持清醒,並能依命令做出口腔反應,故在此氣體給牙醫師帶來極大的方便。結構
 一氧化二氮
一氧化二氮物理性質
熔點-90.8℃沸點-88.49℃
臨界溫度26.5℃[2]
臨界壓力7.263×10⁶Pa
相對密度1.977
折光率1.0005-7265bar
化學性質
加熱硝酸銨可以生成一氧化二氮和水:,工業上對硝酸銨熱分解可製得純度95%的一氧化二氮,一個笑氣分子與六個水分子結合在一起。當水中溶解大量笑氣時,再把水冷卻,就會有笑氣晶體出現。把晶體加熱,笑氣會逸出。人們利用笑氣這種性質,制高純笑氣。毒理學
急性毒性:一氧化二氮作為吸入麻醉劑在醫藥上套用已久,已經少用它了。吸入一氧化二氮和空氣的混合物,當其中氧濃度很低時可致窒息;吸入80%一氧化二氮和氧氣的混合物引致深麻醉,甦醒後一般無後遺作用。製取方法
原理硝酸銨在169.5℃熔融,在220℃分解成一氧化二氮和水
用品
大試管、鐵架台、酒精燈、水槽、集氣瓶、乾燥硝酸銨粉末
操作
1.在能適當加熱的乾燥裝置中,在80--100℃的溫度下,使硝酸銨充分乾燥。然後用乾的研缽磨碎,再在80--100℃的溫度下乾燥後,迅速放入瓶里加塞保存備用。
2.取2g上述乾燥的硝酸銨,加入乾燥的試管里,加熱(剪短酒精燈的燈芯,使火焰不太大)後。硝酸銨熔融成液體,以後像水沸騰那樣,氣泡翻滾。用向上排空氣法收集一氧化二氮氣體。
備註
1.本實驗加熱的溫度不宜過高。溫度過高,可能分解生成氮氣、一氧化氮和二氧化氮。特別是在高溫下容易引起爆炸。
2.硝酸銨的用量控制在2g左右,以免發生爆炸。
3.試管口應略低於水平。這樣就能避免反應生成的水跟加熱部分接觸,引起試管破裂。
4.2g硝酸銨在常溫、常壓下理論上能收集到610mL一氧化二氮,但由於部分熔融硝酸銨隨生成的水流去,只能收集到300mL氣體,用一隻250mL集氣瓶就可以了
另外還可以用無水硝酸鈉和無水硫酸銨混合物加熱分解製得但是上面這些製備方法都是紙上談兵,實施起來需要高溫操作,比較危險,而且純度還難以保證。
其他製取方法:1、2、4實際上實驗室最方便的製備笑氣的方法是鹼分解硝基脲
這個反應的原理是,硝基脲水中水解生成硝醯胺,H₂N-NO₂
有鹼存在時,HOCN與鹼反應成鹽,生成NaOCN
同時,鹼催化下H₂N-NO₂發生脫水反應生成N₂O,也就是笑氣
鹽酸羥胺和亞硝酸鈉反應方程式
(歸中反應)
將鹽酸羥胺溶液與亞硝酸鈉溶液混合即可生成大量笑氣
套用
助燃劑
使用氮氧加速系統的改裝車輛將一氧化二氮送入引擎,遇熱分解成氮氣和氧氣,提高引擎燃燒率,增加速度。氧氣有助燃作用,加快燃料燃燒。火箭氧化劑
一氧化二氮可以用作火箭氧化劑。這比其他氧化劑優勢化處是因為它是無毒的,在室溫下穩定,易於儲存和相對安全地進行飛行。第二個好處是可以很容易分解成呼吸的空氣。醫學
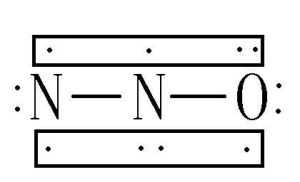
【別名】笑氣,氧化亞氮,連二次硝酸酐【分子結構】一氧化二氮分子為直線形分子,極性分子。N₂O的分子是直線形的(N-N-O),中心N原子採取sp雜化,生成兩個σ鍵,兩個三中心四電子π鍵,N的氧化數為+1。【英文名稱】NitrousOxide西班牙名稱:OxidoNitroso
【醫學適應症】因全麻效果差,常與氟烷、甲氧氟烷、乙醚或靜脈全麻藥合用。現已少用。氧化亞氮(N2O)用於麻醉,對呼吸道無刺激,對心、肺、肝、腎等重要臟器功能無損害。在體內不經任何生物轉化或降解,絕大部分仍以原藥隨呼氣排出體外,僅小量由皮膚蒸發,無蓄積作用。吸入體內只需要30s~40s即產生鎮痛作用,鎮痛作用強而麻醉作用弱,受術者處於清醒狀態(而不是麻醉狀態),避免了全身麻醉併發症,手術後恢復快。
【醫學上用量用法】吸入:用量視手術需要和病人情況而定。
【醫學上注意事項】1.大手術需配合硫噴妥鈉及肌肉鬆弛劑等;吸入氣體中氧氣濃度不應低於20%;麻醉終止後,應吸入純氧10分鐘,以防止缺氧。2.當病人有低血容量、休克或明顯的心臟病時,可引起嚴重的低血壓。氧化亞氮對有肺血管栓塞症的病人可能也是有害的。
【禁忌症】(1)氣囊腫(2)腸梗阻、腸脹氣(3)氣胸(4)氣腦(5)高頭位開顱手術
【醫學藥品規格】氣體:用耐壓鐵筒裝。
【貯藏】置耐壓鋼瓶內,在涼暗處保存。
【作用與用途】吸入純粹該品氣體能迅速引起麻醉狀態和窒息,因此,必須與氧混合使用。誘導時間短。若不補充維持劑量,可迅速甦醒。該品可用於馬、反芻動物、犬和貓的維持麻醉。
【用法與用量】該品用耐高壓鋼瓶盛裝。用於小動物麻醉:75%氧化亞氮同25%氧混合,通過面罩給予2-3分鐘,然後再加入氟烷,使其在氧化亞氮和氧混合氣體中達3%濃度,直至出現下頜鬆弛等麻醉徵象為止。
應急處理
 一氧化二氮
一氧化二氮呼吸系統防護:一般不需特殊防護。高濃度接觸時可佩戴自吸過濾式防毒面具(半面罩)。
眼睛防護:一般不需特殊防護。
身體防護:穿一般作業工作服。
手防護:戴防化學品手套。
其他防護:避免高濃度吸入。進入罐、限制性空間或其他高濃度區作業,須有人監護。
泄漏應急處理:迅速撤離泄漏污染區人員至上風處,並進行隔離,嚴格限制出入。建議應急處理人員戴自給正壓式呼吸器,穿一般作業工作服。儘可能切斷泄漏源。合理通風,加速擴散。漏氣容器要妥善處理,修復、檢驗後再用。
有害燃燒產物:氧化氮。
滅火方法:該品不燃。消防人員須佩戴防毒面具,穿全身消防服,在上風向滅火。用霧狀水保持火場中容器冷卻。迅速切斷氣源,用水噴淋保護切斷氣源的人員,然後根據著火原因選擇適當滅火劑滅火。
管理信息
操作的管理:密閉操作,提供良好的自然通風條件。操作人員必須經過專門培訓,嚴格遵守操作規程。遠離火種、熱源,工作場所嚴禁吸菸。遠離易燃、可燃物。防止氣體泄漏到工作場所空氣中。避免與還原劑接觸。搬運時輕裝輕卸,防止鋼瓶及附屬檔案破損。配備相應品種和數量的消防器材及泄漏應急處理設備。儲存的管理:儲存於陰涼、通風的庫房。遠離火種、熱源。庫溫不宜超過30℃。應與易(可)燃物、還原劑分開存放,切忌混儲。儲區應備有泄漏應急處理設備。
運輸的管理:採用鋼瓶運輸時必須戴好鋼瓶上的安全帽。鋼瓶一般平放,並應將瓶口朝同一方向,不可交叉;高度不得超過車輛的防護欄板,並用三角木墊卡牢,防止滾動。嚴禁與易燃物或可燃物、還原劑等混裝、混運。夏季應早晚運輸,防止日光曝曬。鐵路運輸時要禁止溜放。
廢棄的管理:處置前應參閱國家和地方有關法規。廢氣直接排入大氣。
環境效應
在環境科學研究中,特別是在全球氣候變化領域(GlobalClimateChange),N2O通常被稱為氧化亞氮,是一種溫室氣體(GreenhouseGas),具有溫室效應(GreenhouseEffect),加劇全球變暖(GlobalWarming),是《京都議定書》規定的6種溫室氣體之一。N2O在大氣中的存留時間長,並可輸送到平流層,導致臭氧層破壞,引起臭氧空洞,使人類和其它生物暴露在太陽紫外線的輻射下,對人體皮膚、眼睛、免疫系統造成損害。與二氧化碳相比,雖然N2O在大氣中的含量很低,屬於痕量氣體(tracegas)但其單分子增溫潛勢卻是二氧化碳的298倍(IPCC,2007);對全球氣候的增溫效應在未來將越來越顯著,N2O濃度的增加,已引起科學家的極大關注。對這一問題的研究,正在深入進行[6]。
大氣N2O的重要來源之一是農田生態系統,在土壤中,N2O是由硝化、反硝化微生物產生,人們向農田中施入過量氮肥,促進微生物活動,通過硝化、反硝化過程(nitrificationanddenitrification)使氮素轉化為N2O[7-8]。
監測方法
現場應急監測
攜帶型氣相色譜法。實驗室監測
| 監測方法 | 類別 | 來源 |
| 鹽酸萘乙二胺分光光度法 | 空氣 | 徐伯洪,閆慧芳主編:《工作場所有害物質監測方法》 |
| 氣相色譜法 | ? | 參照《分析化學手冊》(第四分冊,色譜分析)(化學工業出版社) |

