背景資料
 DNA損傷修復,光復活
DNA損傷修復,光復活 衰老雖然不可抗拒,但可以延緩,當我們探索了衰老機理之後,延長老年人的健康期,縮短其帶病期,提高老年人的生命質量、延長壽命是完全可能的。
人類壽命的長短是由遺傳和環境因素共同決定的。目前有據可查,活得最長的壽星是法國的吉娜·卡爾基,她活了122歲零164天。當代科學家一般認為,人類的最高壽限約120歲,因為最高壽限關係到生理性衰老,也就是自然衰老過程。那么,為什麼不能人人活百歲呢?醫學研究認為,因為疾病或其他因素往往加速了人體衰老,也就是病理性衰老。病理性衰老不同於自然衰老,可因人而異,千差萬別,也就出現了人類的平均壽命,如果能防止疾病及其他不利因素,可以避免過早衰老,提高平均壽命。
人從出生到16歲,各組織、器官的功能逐漸增加,快速增長,直線上升。16歲至20歲漸趨平穩,此平穩期可延至30~35歲。35歲以後各個組織、器官功能就逐漸下降了。組成人體的各組織、器官功能減退的速度,也就是衰老的速度,隨著年齡的增加,50~60歲的人,各組織、器官的功能要比其40~50歲時衰退快。
所以,中老年是人體抗衰老的關鍵時刻,廣大中老年人應當把抗衰老作為人生重要的奮鬥目標,努力防治病理性衰老,實現人人活百歲的目標是完全可能的。
DNA損傷修復
目前,解釋生物衰老原因的學說不下數十種,但是每一種學說都只能解釋這個複雜生命現象的一部分。這裡只介紹近代公認的三種衰老學說。 DNA損傷修復說是其中之一。細胞是各組織、器官的基本組成單位,細胞由細胞核、細胞質、細胞膜及線粒體等組成。細胞核含DNA,DNA是什麼呢?DNA是遺傳信息的攜帶者,它是由兩條脫氧核糖核酸鏈組成的,這兩條鏈互相纏繞形成麻花狀。由於DNA含有許多基因,攜帶著遺傳信息,它可將遺傳信息,從親代傳到子代。基因是遺傳的物質基礎,對衰老出現的遲早、進程的快慢、壽命的長短起著決定性作用。
細胞核內的DNA,在內環境如氧自由基、外環境如紫外線與化學物質等影響下,會受到損傷,使DNA鏈發生斷裂。基因受到損害後,遺傳信息就不能由親代不折不扣地傳往子代。但是,我們的細胞中還有一整套DNA修復酶,它能徹底修復損傷的DNA鏈,這樣就能保證遺傳信息從親代正確地傳到子代,人體細胞更新才能夠延續。
可是這種修復能力會隨著年齡的增加逐步下降,導致損傷DNA的累積,有些基因不能正常表達,最終便導致了衰老。科學家們研究發現:對DNA損傷修復能力越強的物種,它的壽命越長;修復能力越差的物種,它的壽命越短。人的最高壽限約120歲,修復能力最強;大象62年,修復能力低於人;鼠類僅3~4年,修復能力最低,由此可見DNA損傷修復能力與物種壽命呈正相關。
修複方法
 切除修復
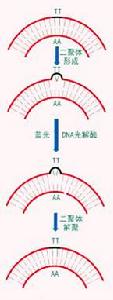
切除修復(一)光復活
光復活(photo-reactivation)又稱光修復(photo-repair)。在可見光照(波長310~440nm)照射下,光復活酶(photoreacting enzyme)發生作用。在暗處,光複合酶能識別出因紫外線照射而形成的酶和DNA複合物,但不能解開二聚體,由光提供能量,才使二聚體解開成為單體,然後酶從複合物中釋放出來,完成修復過程。
這種修複方式雖然普遍,但主要是低等生物的DNA損傷修復的方式。
(二)切除修復(excision repair)
切除修復又稱切補修復,是在一系列複雜酶的作用下,促進DNA損傷修補,主要包括:核酸內切酶識別DNA損傷部位,並在5’端作一個切口,再在外切酶的作用下從5’端到3’方向切除損傷部位,此後在DNA聚合酶的作用下以損傷處相對應的互補鏈為模板合成新的DNA單鏈片段,填補切除後空下的空隙;最後在連線酶的作用下將新合成的單鏈片段與原有的單鏈以3’,5’磷酸二脂鍵相連線完成修復過程。切除修復功能廣泛存在於原核生物和真核生物中,也是人類細胞中DNA損傷切除修復的主要方式之一。
(三)重組修復(recombinational repair)
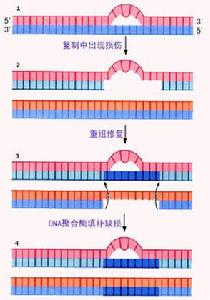
重組修復又稱旁路修復(bypass repair),通過細胞間期DNA合成期來修復損傷。重組和修復的共同處:都需要核酸內切酶的存在,用於切斷DNA雙鏈中一條鏈;都需要核酸外切酶的參與,把DNA的片段切除;都需要DNA聚合酶的催化,合成單鏈DNA片段,彌補DNA鏈上的缺口;都需要連線酶的作用,把新鏈和舊鏈以共價鍵連線起來。由於DNA的重組合修復關係密切,故DNA分子的損傷有可能通過DNA分子間的重組來修復,即重組修復。
重組修復的主要步驟有:
1.複製
含有TT或其他結構損傷的DNA仍然可以正常的進行複製,但當複製到損傷部位時,子代DNA鏈中與損傷部位相對應的位置出現切口,新合成的子鏈比未損傷的DNA鏈要短。
2.重組
完整的母鏈與有缺口的子鏈重組,缺口由母鏈來的核苷酸片段彌補。
3.再合成
重組後母鏈中的缺口通過DNA多聚酶的作用合成核酸片段,然後由連線酶是新片段與舊鏈連線,至此重組修復完成。
重組修復並沒有從親代DNA中去除二聚體。當第二次複製時,留在母鏈中的二聚體仍使複製不能正常進行,複製經過損傷部位時所產生的切口,仍舊要用同樣的重組過程來彌補,隨著DNA複製的繼續,若干代以後,雖然二聚體始終沒有除去,但損傷的DNA鏈逐漸“稀釋”,最後無損於正常生理功能,損傷也就得到了修復。
其他學說
 DNA損傷修復、(三)重組修復
DNA損傷修復、(三)重組修復氧分子具有雙重性,它既是人類七大營養素之一,同時也對人體具有一定危害。氧自由基主要來自我們體內,我們每日三餐吃進去糧食、油和魚、肉、蛋在體內各組織細胞里的線粒體中進行氧化,同時產生二氧化碳、水及能量(即ATP)。二氧化碳通過呼吸,由肺呼出,能量以ATP形式供各組織、器官用以維持生理活動,以供心臟跳動、胃腸蠕動、大腦記憶等等。在糖、脂類及蛋白質的氧化過程中除能量外,還產生了不少氧自由基。
研究發現,氧自由基可以引起DNA單鏈斷裂,也可引起DNA雙鏈斷裂。修復損傷DNA的能力隨年齡增加而下降,人年紀大了,修復能力差,損傷的DNA就會積累,基因功能也會受影響,促使細胞逐漸衰老乃至死亡。
氧自由基還會損害蛋白質與細胞膜,可使蛋白質變性。如果受損害的蛋白質和神經傳導有關,則神經傳導就會失靈。此外,氧自由基還損傷脂類,引起脂質過氧化,脂質過氧化以後,又可再產生氧自由基,形成惡性循環。
第三種學說:端粒假說
端粒是指細胞核內染色體末端的一段特殊的結構,由端粒酶合成。這種結構可以防止兩條染色體間互相交聯,如交聯可引起染色體畸變,會引發腫瘤。另外,它也可防止損傷的DNA修復得不正確。端粒有一定長度,隨著年齡增加,端粒長度會越來越小、越來越短,有人認為端粒長短與人類個體的壽命有關。
2003年國外科學家發現,血細胞端粒短的人,壽命較短,其心臟病病死率是端粒長的人3.18倍,傳染病病死率是端粒長者的8.54倍。2004年有人認為,老年糖尿病、老年人創傷癒合緩慢、免疫功能下降、肌肉萎縮、動脈粥樣硬化及腫瘤發生等,均可能與相應細胞端粒較短有關。總之,端粒長度是人類體細胞衰老的標誌之一。
女性壽命往往比男性長,這是一種普遍的社會現象。為什麼女性壽命比男性壽命長呢?科學家對此進行了一系列研究,認為:①從遺傳因素看,女性性染色體是XX,男性性染色體是XY。有一種清除氧自由基相關的酶,叫6-磷酸葡萄糖脫氫酶,它的基因定位在X染色體,從這一點看,女性抗氧自由基損傷的能力比男性強。②調節細胞周期的有關酶也定位於X染色體,因此女性在細胞周期調節方面可能比男性有優勢。③有些學者認為,女性壽命長可能還與雌激素有關。雌激素可以刺激生長激素和催乳激素分泌,加強胸腺功能,提高免疫力;雌激素還有利於膽固醇和脂蛋白代謝,使女性動脈粥樣硬化患病率低於男性。④端粒長度的縮短速率,男性比女性快。北京大學衰老研究中心研究發現,男性在年輕時其端粒長度比同齡女性稍長,但隨年齡增加,端粒縮短速率快於女性,男性每年端粒長度丟失速率比女性快3個鹼基對。上述原因可能決定了男女壽命的差異。
以上介紹了現代公認的三種生物衰老學說。此外,還有其他學說:如線粒體DNA損傷學說、基因調控學說、神經內分泌學說、免疫學說、蛋白質合成差錯累積學說等等。隨著衰老機理研究的不斷深入,必將對人類延緩衰老發生積極的作用。
