性質
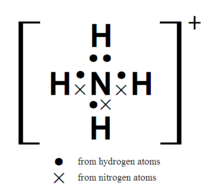 銨根離子的電子式
銨根離子的電子式由氨衍生的一種離子NH₄或基“―NH₄”。也叫“銨根”,它是化
學中的一種陽性復根,用NH₄表示。它和一價金屬離子相似。它的鹽類稱為銨鹽。如化肥硫銨和碳酸銨的分子都含有銨。
銨離子的性質和鉀離子相近,在溶液中呈+1價。銨鹽都呈白色晶體,加鹼研磨能生成有刺激性氣味的氨氣(化學式:NH₃),銨鹽受熱會分解。
結構
銨離子是正四面體型的,與甲烷互為等電子體。
用途
用於銨鹽中含氮,鹽可用作氮肥,稱為銨態氮肥。此類肥料不宜與鹼性肥料混用,否則銨離子會被反應掉從而肥效降低。
常見的銨態氮肥有:硫銨、碳銨、硝銨
檢驗方法
銨鹽的檢驗方法通常是與鹼混合(必要時加熱),會放出氨氣。例如:
NH4HCO3+Ca(OH)2=CaCO3+2H2O+NH3↑
(NH4)2SO4+2NaOH=Na2SO4+2H2O+2NH3↑
原理是銨鹽與鹼發生複分解反應,生成新鹽和一水合氨,一水合氨易揮發為氨氣和水。
NH4+OH=NH3↑+H2O
銨鹽可以與奈斯勒試劑反應生成黃棕色沉澱,用於定性檢驗。
NH4+ 2[HgI4] + 4OH→ HgO·Hg(NH2)I + 7I+ 3H2O
