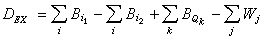概 述
熱力學分析(thermodynamic analysis),又稱第二定律分析(second-lawanalysis)或㶲分析(exergyanalysis),是套用熱力學基本原理分析能量轉換過程的有效性和合理性的一門實用性學科,它的基礎是熱力學第二定律,即過程不可逆原理的套用。
熱力學第一定律是能量守恆定律,它無法回答為什麼能源會匱乏的問題。熱力學第二定律指出,實際過程是不可逆的,能量雖然在數量上守恆,但不同形式的能量的可轉換性卻是不守恆的,這就是說,能量存在質的差別。熱力學分析以數量和質量(晶位)兩個方面研究能量的轉換過程,道出了用能過程的本質和節能的關鍵。
熱力學分析的理論基礎全部包含在經典熱力學之中,但是在處理方法上有其特點,熱力學分析特彆強調要把系統放在給定的環境中考查,將系統和環境一併考慮。熱力學分析通常研究實際的開式系統,而不是閉式循環。
早在19世紀末,熱力學家J.W.Gibbs和工程熱力學家G.Gouy及丸Stodola就分別提出了能量的可用性、能量相位以及損耗功等概念。20世紀30年代,美國工程熱力學家J.H‘Keenan首次提出 availability 函式,德國的F.Bosnjakovic提出technische Arbeitfahigkeit 函式。50年代前南斯拉夫的Z.Rant首創exergy一詞,得到了國際公認。這樣,過程熱力學分析逐漸形成了完整體系。70年代以來,能源問題受到舉世矚目,熱力學分析成為開展節能研究的有力工具,在理論上更為完備,套用領域日益擴大,以動力、製冷等過程推廣到所有化工過程、單元操作、太陽能及其它新能源利用等領域。熱力學分析被認為是工程熱力學在本世紀取得成就最大的一個分支。
基本方法
過程熱力學分析就是用熱力學方法對過程中能量轉化、傳遞、使用和損失情況進行分析,揭示出能量消耗的大小、原因和部位,為改進過程,提高能量利用率指出方向和方法。
熱力學分析方法有三種,能量衡算法、熵分析法、㶲分析法。
能量衡算法
以熱力學第一定律為基礎,通過物料衡算、能量衡算求出過程總能量的利用率(代表第一定律的效率)。
能量損失與㶲損失 建立了㶲和㷻的概念後,我們對能量的守恆性和實際過程的不可逆性有了較深的認識。能量守恆是指在一切過程(無論可逆的還是不可逆的過程)中,㶲和㷻的總量保持恆定。若分別討論㶲和㷻則只有在可逆過程中,兩者才各自保持恆定;而在實際不可逆的過程中,都會導致㶲向㷻的轉化。
能量損失與㶲損失在概念上是完全不同的。由於能量是守恆的,所以籠統地講能量損失是違反熱力學第定律的。通常講的能量損失是指某個系統的㶲和㷻的總量損失,它是一種外部損失,又稱排出損失,即通過各種途徑散失和排放到環境中去的能量,如排出系統的廢氣、乏汽、冷卻水、冷能水、廢液、廢渣等帶走的能量、保溫不良的熱損失。
㶲損失包括兩部分,內部損失和外部損失。內部損失是由系統內部各種不可逆因素造成的㶲損失。例如,直接接觸式換熱器或間壁式換熱器的有溫差△T的傳熱,吸收、精餾、萃取塔中上升和下降的兩相流體之間有濃度差△c的傳質,管道中、設備中有壓差△p為推動力的流體流動(包括節流),在反應設備中進行的有化學位差△μ的化學反應過程。外部損失是通過各種途徑散失和排放到環境的㶲損失,如廢氣、乏汽、冷卻水、冷凝水、廢液、廢渣帶走的炯、保溫不良的炯損失。
工程上各種能源實際上就是㶲源,而環境介質中儲存的大量能量都是不能利用的。有些人往往將能量的概念和㶲的概念等同起來,要注意兩者的差異。
熵分析法
熵分析法是通過計算不可逆熵產量,以確定過程的損耗功和熱力學效率。熵分析法的主要內容包括: ·
①確定出入系統的各種物流量、熱流量和功流量,以及各物流的狀態參數;
②確定物流的熵變和過程的損耗功、㶲損失;
③確定過程的熱力學效率。
由不可逆因素引起的㶲損失就等於相應的㷻增量,所以㶲損失可以用兩種方法計算,一種是㶲平衡法,另一種是㷻平衡法。由㶲平衡法計算㶲損失將在後面介紹,這裡介紹用㷻平衡法計算㶲損失。
WL=ΔA=TΔS
熵分析法的局限性是只能求出過程的不可逆㶲損失,而沒有計算排出系統的物流㶲和能流㶲;也就是說,只能求出有效能的內部損失,不能求出有效能的外部損失。因此。不能確定排出物流㶲和能流㶲的可用性。以及由此而造成的㶲損失。熵分析法的局限性在㶲分析法中可以避免。
㶲分析法
㶲分析法是通過㶲平衡確定過程的㶲損失和㶲效率。㶲分析法的主要內容有:
①確定出入系統的各種物流量、熱流量和功流量,以及各物流的狀態參數;
②由㶲平衡方程確定過程的㶲損失;
③確定熱力學第二定律效率。
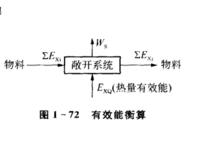 有效能衡算圖
有效能衡算圖下面介紹怎樣進行㶲平衡計算。考察右圖所示的穩流過程,對該系統進行有效能衡算。通常,位能、動能變化較小,可以忽略,對於可逆過程W=0,有效能守恆
E+ΣE= W+ΣE
式中,ΣE為進入系統的物流㶲;ΣE為流出系統的物流㶲;E為進入系統的熱流㶲。對於不可逆過程W>0,㶲衡算式為
E+ΣE= W+ΣE+W
過程熱力學分析內容
化工生產中,人們總是希望能夠合理、充分的利用能源,提高能源的利用率,以獲得更多的功。根據熱力學的基本原理,闡述了理想功、損失功、有效能等一些基本概念和計算,以便評定實際生產過程的能量利用情況,我提高能量利用效率,改進生產提供一定的理論依據。
理想功
理想功是指體系的狀態變化完全按可逆過程進行時所表現出的功,即體系在做功過程中,在給定變化條件下所能夠完成的最大功量,或在消耗功的過程中所需的最小功,對於非流動體系,理想功為
W=TΔS - ΔU - pΔV
式中W為理想功;T為環境的絕對溫度;ΔS和ΔU分別為體系的熵變和內能變化;p是環境的壓力;ΔV是體系的體積變化。
對於穩定流動過程,其理想功表達式為
W=TΔS- ΔH- ΔE- ΔE
其中ΔH為體系的焓變;ΔE和ΔE分別表示動能差和位能差。
在實際套用過程中,許多情況下動能差和位能差往往可忽略不計,於是理想功為
W=TΔS - ΔH
損失功
體系在給定狀態變化過程中所做的可逆功與其相應的實際過程所做的功之間的差值稱為損失功。對於一個不可逆過程,損失功的計算公式為
W=TΔS =T(ΔS+ΔS)
式中W為損失功;ΔS為體系與環境的總熵變;ΔS表示環境的熵變。根據熱力學第二定律,一切自然過程都有ΔS≥0,因此W≥0,這表明任何不可逆過程都有其代價,損失功是正值。
對於穩定流動過程,其損失功可表示為
W=W - W
其中W用上式計算;W為實際功,計算公式為
W=Q- ΔH- ΔE- ΔE
其中Q是相對體系而言的傳熱量。這樣穩定流動過程的損失功便可表示為
W=TΔS -Q
過程熱力學分析的表達式
對於單一步驟過程,其損失功可直接套用式W=W - W計算。對於更為複雜的包括幾個步驟的過程,則必須對每一個步驟分別進行損失功的計算。在此情況下,上式最好改寫成下列形式:ΣW=W - W(式1)式中,累加號是指過程中所有步驟而言。式中各項要分別計算:
全過程的理想功W=TΔS - ΔH
每個步驟的損失功W=TΔS - Q
過程的實際功W=Q- ΔH- ΔE- ΔE
對於產生功的過程,最好將公式1寫成下列形式
W=W+ΣW
上式表明,過程的理想功在數值上等於兩部分功量之和,第一部分是過程的實際功W,第二部分是變為不可利用的那部分功量即損失功ΣW。既然是這樣,理想功即為給定的狀態變化中充其量所能得到的最大功,因此熱力學效率η應為實際功對理想功之比值:
η= W/W
對於接受功的過程,將公式1最好寫成
W=W -ΣW
上式右邊第一項是理想功,代表該過程在給定的狀態變化中所需的最小功,第二項代表過程各個步驟由於不可逆性所引起的損失功。由此可見,對於接受功的過程,實際所需要的功量應大於理想功,於是,其熱力學效率應為理想功對實際功之比:
η= W/ W