簡介
光學顯微鏡憑藉其非接觸、無損傷等優點,長期以來是生物醫學研究的重要工具。但是,自1873年以來,人們一直認為,光學顯微鏡的解析度極限約為200 nm,無法用於清晰觀察尺寸在200 nm以內的生物結構。超分辨光學成像(Super-resolution Optical Microscopy)是本世紀光學顯微成像領域最重大的突破,打破了光學顯微鏡的解析度極限(換言之,超越了光學顯微鏡的解析度極限,故被稱為超分辨光學成像),為生命科學研究提供了前所未有的工具。
光學顯微鏡的解析度
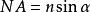 超分辨光學成像
超分辨光學成像1873年,德國物理學家恩斯特·阿貝(Ernst Abbe)提出,光學顯微鏡受限於光的衍射效應和光學系統的有限孔徑,存在解析度極限(也稱阿貝極限),其數值約為l / 2NA(解析度極限公式),其中l是光波波長,NA是光學系統的數值孔徑(Numerical Aperture)。, n為介質的折射率,a為物鏡孔徑角的一半。成像時若使用波長為400 nm的光,並採用空氣(折射率為1)作為物鏡和樣本之間的介質,可計算得到解析度極限為200 nm。因此,我們通常說,光學顯微鏡的解析度極限約為200 nm。
此後的研究表明,光學顯微鏡的解析度決定於光學系統中聚焦光斑(稱為艾里斑, Airy disc)的尺寸。另外,當一個艾里斑的邊緣與另一個艾里斑的中心正好重合時,此時對應的兩個物點剛好能被人眼或光學儀器所分辨(這個判據稱為瑞利判據,Rayleigh Criterion)。利用瑞利判據以及艾里斑的數學表達式,我們可以得到光學顯微鏡的解析度公式:0.61λ/NA。值得指出的是,光學顯微鏡的解析度公式跟前面提到的解析度極限公式有所不同,而前者更廣泛的被光學成像領域使用。
提高光學顯微鏡解析度的途徑
為了提高光學顯微鏡的解析度,早期的工作往往集中在如何減小艾里斑的尺寸,包括減小光的波長、增大數值孔徑。對於前者,直接導致了各種電子顯微鏡的誕生---採用波長為納米甚至亞納米級的電子束進行成像,其解析度可達納米量級甚至更小。對於後者,一方面可以更高折射率的成像介質,例如,將空氣換為水(折射率為1.333),採用400 nm的光進行成像,極限解析度可高達150 nm。另一方面,可以利用結構更為複雜的光學收集系統(如共軛雙物鏡)來增加光學顯微鏡的有效孔徑角,從而提高光學顯微鏡相對較差的軸向解析度,其典型代表為4Pi顯微鏡。此外,還可以使用共焦小孔等來限制艾里斑的尺寸並消除雜散光,從而提高光學顯微鏡的橫向和縱向解析度,其典型代表是共聚焦顯微鏡(Confocal Microscope)。
值得指出的是,這裡所述的光學顯微鏡指的是遠場光學顯微鏡(Far-field Optical Microscope),物鏡和樣本之間的距離遠大於光的波長。進一步的研究表明,遠場光學顯微鏡存在解析度極限的主要原因在於遠場一般只能收集傳導波信號,而攜帶了高頻信息的倏逝波(Evanescent Wave),其電場強度隨傳播距離的增加而呈指數衰減。因此,若使用距樣本表面僅幾個納米的探針收集並探測近場光信號,可以大幅提高光學顯微鏡的解析度,這種思路導致了近場掃描光學顯微鏡(Near-field Scanning Optical Microscope, NSOM)的誕生,其解析度可以優於25 nm。而基於倏逝場掃描成像的光學顯微鏡,通常被稱為近場光學顯微鏡(Near-field Optical Microscope)。
超分辨光學成像技術
超分辨光學成像技術通常指的是基於遠場光學顯微鏡的超分辨成像技術,主要包括兩種實現途徑:一種是基於特殊強度分布照明光場的超分辨成像方法(如STED)。另一種是基於單分子成像和定位的方法(如PALM)。
1.受激發射損耗顯微鏡技術(Stimulated Emission Depletion Microscopy, 簡稱STED)
該成像理論來源於愛因斯坦的受激輻射理論,德國科學家史蒂芬·赫爾(Stefan W. Hell)創造性地利用受激輻射來抑制自發螢光輻射,最終實現了受激發射損耗顯微鏡技術(STED)。一個典型的STED顯微鏡需要兩束嚴格共軸的雷射,其中一束為激發光,另外一束為損耗光(也稱STED光)。利用激發光使艾里斑範圍內的螢光分子被激發,其電子從基態躍遷到激發態。隨後,使用甜甜圈型(Doughnut,跟救生圈形狀類似)的損耗光照射樣品,使得處於激發光斑外圍的激發態分子以受激輻射的方式釋放能量回到基態,而位於激發光斑內部區域的激發態分子則不受損耗光的影響,繼續以自發螢光的方式回到基態。這種照明方式的組合,將螢光發射區域限制在小於艾里斑的區域內,獲得了一個小於衍射極限的螢光發光點。最後,通過在二維(或三維)空間內掃描共軸的激發光和損耗光,獲得一幅二維(或三維)超分辨圖像。1994年,史蒂芬·赫爾等人提出了STED顯微鏡的理論。2000年,史蒂芬·赫爾研究組通過生物實驗證實了STED顯微鏡的超分辨成像能力。
2.光激活定位顯微鏡技術(Photoactivation Localization Microscopy, 簡稱PALM)
阿貝極限指出,在遠場無法分辨相距l / 2NA的兩個螢光分子所成的像,但是並沒有對單個螢光分子的中心位置確定精度進行限制。如果在艾里斑內僅有一個分子在發射螢光, 我們可以利用單分子定位算法並結合光學系統艾里斑的形狀,以超高精度(納米量級)獲得螢光分子的中心位置。倘若將這個單分子定位思想用於實現超分辨成像,其關鍵在於如何在一個艾里斑內區分多個螢光分子。
為了克服一個艾里斑內只允許一個分子發射螢光的限制,1995年美國科學家埃里克·白茲格(Eric Betzig)通過理論分析,提出可以利用光譜特性對艾里斑內的發射波長不同的螢光分子進行分時探測和中心位置定位,從而實現螢光密集標記樣本的超分辨成像。2006年, 埃里克·白茲格等人利用光激活綠色螢光蛋白(PA-GFP)的可控螢光開關特性,結合單分子定位算法,實現了生物樣本的超分辨成像。他們首先利用低能量的 405 nm 雷射(激活光)來稀疏活化PA-GFP,再使用 561 nm雷射(激發光)對活化後的PA-GFP進行單分子螢光成像,直至活化後的PA-GFP分子被光漂白。重複激活-激發-定位-漂白過程,可以在艾里斑內高精度找到大量PA-GFP分子的中心位置,從而重建出一幅由PA-GFP分子中心位置組成的超分辨圖像。這種技術被稱為光激活定位顯微鏡(Photoactivation Localization Microscopy, 簡稱PALM)。
2006年,哈佛大學的莊小威小組提出了隨機光學重建顯微鏡(Stochastic Optical Reconstruction Microscopy,簡稱STORM),其成像原理與 PALM 類似,但是在密集標記樣本內實現螢光發射稀疏化的方案有所不同。
2014年諾貝爾化學獎
2014年10月8日,瑞典皇家科學院宣布,將2014年諾貝爾化學獎授予美國霍華德·休斯醫學研究所的埃里克·白茲格(Eric Betzig),德國馬克斯·普朗克生物物理化學研究所的史蒂芬·赫爾(Stefan W. Hell),美國史丹福大學的威廉·莫爾納(William E. Moerner),以表彰他們在超分辨螢光成像技術領域取得的成績。
