 角膜緣幹細胞 圖1
角膜緣幹細胞 圖1近年來,人們對幹細胞的研究熱情越來越高,幹細胞被譽為新世紀生物和醫學技術領域可能取得革命性突破的項目。幹細胞是一類具有自我更新、高度增值及多向分化潛能的細胞,在體外可誘導人體胚胎幹細胞分化成胰島細胞、神經元、心悸細胞等。目前研究較多的是造血幹細胞、神經幹細胞和角膜緣幹細胞。
概述發現
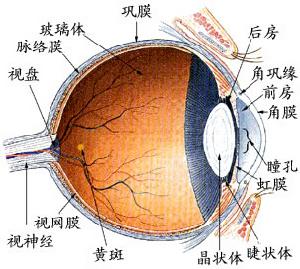 眼睛的結構
眼睛的結構2、角膜緣幹細胞的發現:早在1940 年Hughes[11]提出角膜緣局部缺血和角膜上皮缺損可提示角膜破損的範圍,並作為燒傷眼的兩個主要的預後因素,同時首次提出用角膜和角膜緣上皮移植的方法再造眼表面來改變患眼的預後,1960年Strampeli和1964年Burraquer[12]等也提出了自體角膜緣移植術。後來Devanger和Everse[13]等觀察到角膜緣上皮是角膜上皮細胞的生長來源;1986年,Schermer 等[6] 首次通過實驗證明角膜上皮幹細胞位於角膜緣基底層,尤其是Vogt 柵欄區乳頭狀結構中的角膜緣基底細胞層。Vogt柵欄區乳頭狀結構中的某些基底細胞就是角膜緣幹細胞,其依據為[7-10]:①角膜緣基底部上皮含有角膜上皮中分化程度最低的細胞;角膜上皮表達K3是角膜上皮分化成熟的標誌,角質蛋白K3和K12存在於角膜緣上皮基底層以上及整個角膜上皮,但不表達於基底層上皮及結膜上皮,表明基底層細胞包含分化最低的上皮細胞幹細胞。②角膜緣基底層上皮含有具有幹細胞增殖特性的細胞。③角膜緣上皮部分或全部缺損后角膜上皮的癒合反應支持幹細胞位於角膜緣。④Pellegrini等發現P63 轉錄因子可以把人類角化細胞的幹細胞和它們的短暫擴充細胞(TACS) 區別開來,它表達於角膜緣基底細胞核,但不表達於TACS。⑤正常角膜緣嚴重破壞時,移植自體或異體角膜緣上皮,可恢復正常角膜表面結構。
歷史回顧及進展
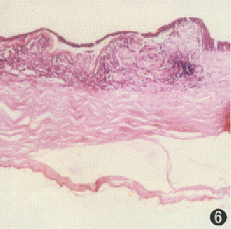 角膜緣幹細胞治療後第35天兔角膜緣可見多層上皮細胞,羊膜下可見炎性細胞浸潤 HE染色 ×100
角膜緣幹細胞治療後第35天兔角膜緣可見多層上皮細胞,羊膜下可見炎性細胞浸潤 HE染色 ×100角膜移植技術的理論自提出之後,相繼有4種較成熟的方法可以運用於臨床。
1、自體角膜緣幹細胞移植自:1977 年Thoft[14]成功套用自體結膜移植治療化學燒傷角膜開始, 1989年Kenyon和Tseng[15]開始了自體角膜緣移植術研究, 並套用於治療各種原因導致角膜緣幹細胞缺損為特徵的角膜疾病中, 該手術將自體健眼包括角膜緣幹細胞在內的球結膜組織片移植到患者的角膜緣部,其結果發現,比結膜移植有明顯療效, 移植後的角膜表面光滑,角膜新生血管消退,角膜上皮覆蓋[16] ,這一事實進一步支持了角膜緣幹細胞的功能與臨床套用價值。但發現在自體供眼移植術中,如切取植片範圍大於2 /3周,供體眼則產生不可逆的異常變化[17] ,而且在切取供體移植片時存在著一定的手術技術困難,對於雙眼患者來說這種方式並不能完美的解決問題。因此有些學者提出了異體角膜緣幹細胞移植的手術方式。
2、異體角膜緣幹細胞移植:Tan等[18] 和Coster等[24]先後報導了採用同種異體角膜緣移植術重建眼表的病例,術後隨訪發現效果良好,重建的眼表穩定,角膜上皮完整,新生血管消退,部分視功能恢復。雖然為降低排斥反應,有人採用親屬間HLA-DR抗原相同或相近的角膜緣幹細胞移植,並且在術後加用免疫抑制劑,但是畢竟是同種異體間的細胞移植,排斥反應仍舊很明顯。於是在此基礎上自體幹細胞的培養和移植的手術方式也就被提出來了。
3、自體角膜緣幹細胞體外培養移植:1997年Rellagrim[24]等首次將體外培養的自體角膜緣幹細胞移植到患眼上,並隨訪兩年保持上皮的正常和完整性,成功地實現了眼表重建。後來的學者也以羊膜為載體進行同樣的移植手術,實驗證明角膜上皮形成。這種技術能夠克服角膜緣幹細胞匱乏的特點,成功率高,同時還避免了異體間的排斥反映,是一種理想的移植術。
4、異體角膜緣幹細胞體外培養移植:對一些重症病人來說,自身角膜緣幹細胞貧乏,採用異體角膜緣幹細胞體外培養是一種可行的方法。1994年Tsai和Tseng[25]實施了來源於屍眼上的遺體角膜緣移植,另外還有多位學者都進行異體角膜緣移植,術後療效得到了提高,因體外培養同種異基因的角膜緣細胞植入異基因受體後,免疫原型隨培養而降低。這樣能從一定程度上減小排斥反映,但不能從根本上避免免疫排斥反映的發生,這仍然是該方面的一大障礙。
另外,有人提出可以將胚胎幹細胞誘導形成角膜緣幹細胞,為角膜緣幹細胞移植和眼表重建提供了充足的細胞來源,而且該細胞個體間差異小,幾乎無表面抗原表達,為治療此類疾病提供了新的思路。
臨床套用
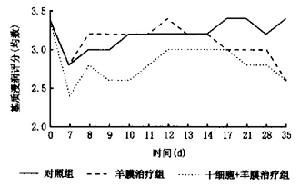 角膜幹細胞移植治療角膜緣鹼燒傷角膜基質浸潤評分
角膜幹細胞移植治療角膜緣鹼燒傷角膜基質浸潤評分1、適應徵[3、19、21]:一般適應於廣泛角膜緣纖維性血管向內生長者, 且已持久或復發達7個月~20年不等的角膜上皮疾病。(1) 中、重度化學燒傷或熱燒傷; (2) 慢性接觸性相關角膜上皮病; (3) 假性胬肉、翼狀胬肉和復發性胬肉; (4)Terrien‘s邊緣角膜變性; (5) 慢性復發性角結膜炎; (6) 角膜上皮瘤; (7) Steve - jonnson綜合徵的表層; (8) 多次角膜緣術后角膜表層瘢痕; (9) 持久性角膜上皮缺損。
2、供體的選擇[3、22]:(1)自體角膜緣幹細胞移植: 適應單眼發病的患者,取另一眼上方或下方角膜緣組織。(2)同種異體角膜緣幹細胞移植: 活體- - 患者健康親屬, 如父母、兄弟等; 屍體- - 健康屍體眼球。
3、植床準備:根據病灶大小,清除缺血的角膜緣結膜及結膜下瘢痕組織, 暴露2mm寬的鞏膜及角膜緣組織片, 板層切除角膜表面不正常上皮、纖維血管翳、角膜表面瘢痕、使角膜創傷面平滑,避免角膜實質層切除。
4、植片大小[2、18、19]:根據病灶範圍採取植片,取角膜緣015~1mm寬的表層透明角膜上皮並帶有寬的2mm結膜, 避免取筋膜, 先切透明角膜邊緣側,再切結膜側,活體供眼在表面麻醉取下, 創口可保留開放或用8~0號可吸收的縫線縫合傷口,所有活體供眼傷口快速癒合,無異常變化。植片大小從5mm~10mm不等,寬度2~3mm角膜緣組織,用10~0尼龍線在角膜緣側間斷縫合, 8~0可吸收縫線在鞏膜側間斷縫合。
5、術後處理[18、19、20]:術畢結膜下注射抗生素、激素,單眼加壓包紮,佩戴治療性眼接觸鏡或瞼緣縫合保護植片,術後3周拆除縫線,常規用抗生素和激素滴眼, 如為同種異體移植;術後可口服環胞黴素8~12 mg/kg,為期1周隨後減為4~5mg/kg,持續2~6周, 全身套用環胞黴素時應注意腎功能和血壓變化,可用1%環胞黴素A滴眼液滴眼,自體移植的角膜緣上皮在3天內可完全覆蓋角膜, 同種異體移植在術後7天內, 術後2~9天移植的上皮已完全覆蓋角膜。
6、術後併發症[18、20]:術後未遇到任何感染和植片移植急性失敗, 術後併發症歸納如下:
(1)上皮生長遲緩: 常見的原因可有供體不理想, 植片覆蓋不均勻,縫合技術失敗及淚液分泌功能障礙等。
(2)植片裂開:常由於縫合不牢或過早拆線後未採取有效保護措施等原因造成。
(3)植片排斥反應: 同種異體移植後有些患者出現角膜緣血管充血, 繼而誘發角膜上皮排斥, 通過局部套用糖皮質激素及環胞黴素A即可防治這種現象的發生。HLA基因配型從根本上防治異體移植排斥反應的發生。
(4)舊病復發: 因移植失敗或移植的幹細胞存活量太少,導致上皮再生不足等。
展望和問題
綜上所述,角膜緣幹細胞移植術是治療眼表疾病、重建角膜結構的有效手段。
其中自體移植雖然有諸多優點,如移植成功率是最高的,沒有排斥反應,組織來源方便等, 但僅能供單眼發病的病例, 手術取植片範圍常常受限。目前我國每年所實施的角膜移植例數遠不及每年遞增的角膜病患者。
培養角膜緣幹細胞是基於對角膜緣幹細胞的深入認識和對傳統方法的重大革新,具有良好的發展前景。
它的優點是:1、所需角膜緣組織極少,對供眼無潛在威脅;2、培養的細胞可冰存用於二次手術;3、能抑制眼表急性病變的發展,迅速恢復術眼正常的眼表結構;4、可避免使用異體移植而導致的免疫排斥反應;5、解決了供體來源不足的難題[3]。這一方法是最有前途的研究方向, 一旦該方法研究成熟, 可解決角膜緣幹細胞的來源。
雖然如此,但還有很多工作需要做,如培養後的角膜幹細胞分化及生理生化的變化、如何選擇安全可靠的載體、培養的肝細胞如何保存效果會更好、異體移植後如何降低排斥反映的發生等一系列問題都亟待解決。
人體幹細胞
| 成體幹細胞;神經幹細胞;造血幹細胞;角膜緣幹細胞;胚胎幹細胞;臍帶血幹細胞;雌性生殖幹細胞;多能幹細胞;豬萬能幹細胞;全能幹細胞;精原幹細胞;腫瘤幹細胞;毛玻璃樣幹細胞;蘋果乾細胞;胚胎幹細胞;癌幹細胞;間充質幹細胞;肌肉干細胞;骨髓造血幹細胞;紅細胞樣幹細胞;誘導性多能幹細胞;球蛋白 |
