原理簡介
組成物質的原子中,有不同數量的粒子(電子)分布在不同的能級上,在高能級上的粒子受到某種光子的激發,會從高能級跳到(躍遷)到低能級上,這時將會輻射出與激發它的光相同性質的光 .能級躍遷首先由波爾提出,但是波爾將巨觀規律用到其中,所以除了氫原子的能級躍遷之外,在對其他複雜的原子的躍遷規律的探究中,波爾遇到了很大的困難。
詳細內容
氫原子能級
 能級躍遷
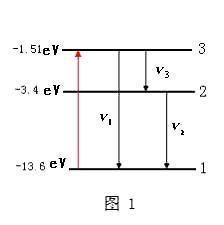
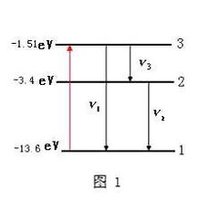
能級躍遷1)氫原子能級: 原子各個定態對應的能量是不連續的,這些能量值叫做能級。①能級公式:E(n)=E(1)/n^2
②半徑公式:r(n)=n^2*r(1)
在氫光譜中,n=2,3,4,5,…向n=1躍遷發光形成賴曼線系n=3,4,5,6……向n=2躍遷發光形成巴耳末線系;
n=4,5,6,7……向n=3躍遷發光形成帕邢線系;
n=5,6,7,8……向n=4躍遷發光形成布喇開線系,
其中只有巴耳末線系的前4條譜線落在可見光區域內。
③能量最低的能級叫做基態,其他能級叫做激發態。當電子“遠離”原子核,不再受原子核的吸引力的狀態叫做電離態,電離態的能級為0(電子由基態躍遷到電離態時,吸收的能量最大) 。