引言
實驗觀察,正常血漿 滲透壓約為290-310mmol/L。凡是和此 滲透壓近似相等的溶液為等滲溶液。 人體中的血漿、 胃液,胰液、腸液、膽汁、脊髓液,以及淚液的 滲透壓都大致相等。為使藥液與人體內各種液體的滲透壓保持平衡,常配製等滲溶液,常用的方法有滲透壓法、 氯化鈉等滲等量法和冰點下降數據法、容積價法及毫滲分子法五種方法。
濃度為280~320mmol/L的溶液稱為等滲溶液,如:
1. 生理鹽水(0.154mol·L-1NaCL溶液),毫滲透量濃度為308mmol/L即0.9%NaCl。
2. 0.278mol·L-1葡萄糖溶液,亳滲量溶液濃度為278mmol/L(近似於280mmol/L)
即5%葡萄糖。
3. 0.149mol·L-1碳酸氫鈉溶液,毫滲透量濃度為298mmol/L。
等滲溶液
等張溶液是張力相等,等滲溶液是滲透壓相等。
等滲:與血漿滲透壓相等的溶液,屬於物理化學概念。
等張:滲透壓與紅細胞膜張力相等的溶液,屬生物學概念。
如果分子不能透過細胞膜時,等滲和等張相等。
5%葡萄糖 氯化鈉是等滲溶液.
低滲還是高滲還是等滲是根據溶液與血漿的濃度比較而言的,
與血漿滲透壓相等的溶液稱等滲溶液。如5%的葡萄糖溶液或0.9%的 氯化鈉溶液。
比血漿滲透壓低的溶液稱低滲溶液。如 蒸餾水等。
比血漿滲透壓高的溶液稱 高滲溶液。如10%的葡萄糖液或50% 葡萄糖液等。
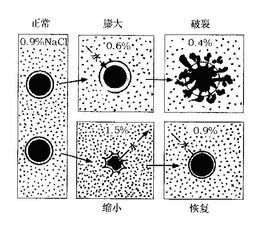
所謂等張液,是指所用液體與紅細胞的張力相等。所謂等滲液,是指與血漿滲透壓近似。從生理觀點來談,在等張液中紅細胞既不腫脹,也不皺縮,維持其原來形狀不變。從理化概念來談,試構想把某種溶液用一個半透膜與血漿隔開,若半透膜兩側的溶液滲透壓相等,這種溶液便是等滲液。
正常情況下,細胞外液和細胞內液的滲透壓是近似的。細胞內外 滲透壓的取得平衡,是依靠細胞內外之間水分的移動。當細胞外液比細胞內液的滲透壓高時,水分由細胞內流向細胞外,反之則由細胞外流向細胞內。無論是 電解質或 非電解質溶液,輸入人體後,其藥物微粒不能進入或很少進入紅細胞內,引起紅細胞內滲透壓相對降低,水分隨之外流,使細胞發生皺縮,這種溶液屬高張液;若藥物微粒過多進入紅細胞內,使細胞內滲透壓隨之增高,部分水分被吸入紅細胞內,使之腫脹,這種溶液屬低張液;當只有某種輸入的溶液不引起紅細胞形態和體積變化時,才能稱為等張液。
臨床中人們習慣把水鹽紊亂形式以滲透壓的變化來表示。例如,失水大於失鹽,引起血鈉濃度高於150mmol/L時,血漿滲透壓>310mOsm/L,稱為高滲性脫水;失鈉多於失水,血清鈉濃度 < 135mmol/L ,血漿 滲透壓 < 280mmol/L。 稱為低滲性脫水;血鈉濃度介於130~150mmol/L時,稱為等滲性脫水。