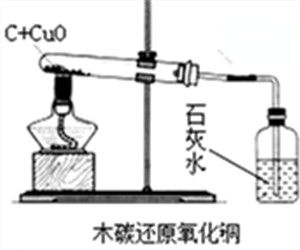
實驗用品
試管、試管夾、鐵架台、水槽、氧化銅粉末、碳粉、藥匙、研缽、研杵、坩堝、泥三角、酒精燈、火柴、坩堝鉗、酒精噴燈、試管、澄清石灰水、玻璃導管、單孔橡膠塞、托盤天平(帶砝碼盒和鑷子)、稱量紙。方程式
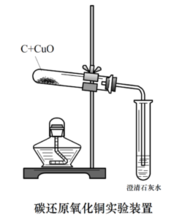 碳還原氧化銅
碳還原氧化銅主要反應:
C+2CuO=高溫=2Cu+CO2↑(置換反應)
副反應:
C + CuO=高溫= Cu + CO↑(炭過量)
碳 氧化銅 銅 一氧化碳
C + 4CuO=高溫=2Cu2O + CO2↑(氧化銅過量)
實驗
操作方法
1、按右圖組裝除裝有澄清石灰水的試管外的所有儀器。2、將玻璃導管一端伸入盛有水的水槽之中並用手握住試管或用酒精燈加熱(加熱前預熱)試管,如玻璃導管口處有氣泡冒出,說明儀器氣密性良好,反之,須在導管與單孔橡膠塞,單孔橡膠塞與玻璃導管重新連線,在連線處塗上少量水。
將托盤天平放置於水平桌面上,在托盤天平的左盤與右盤上放上兩張形狀面積薄厚完全相同的稱量紙。在右盤上用鑷子放置一個10g的砝碼,並用藥匙緩慢向左盤上的稱量紙上加入氧化銅。帶到托盤天平的指針指向正中刻度時,將盛有氧化銅的稱量紙移出托盤天平,並將稱量紙上的氧化銅倒入乾淨的研缽中,經過研磨後把研缽中的氧化銅倒入坩堝中並將坩堝放置在泥三角上用酒精燈加熱(需預熱)。除須稱取1g碳粉外步驟同上。
3、把經過烘乾的碳粉與氧化銅粉末混合均勻,用藥匙或紙槽小心地鋪在試管底部,並根據上圖將試管固定在鐵架台上。並將玻璃導管的一端伸入盛有澄清石灰水的試管中。
4、用酒精噴燈加熱盛有氧化銅粉末與碳粉的試管中(需預熱),集中加熱藥品所在部位(加熱時間不能太長,試管可能會能變形)。當試管中的黑色粉末(氧化銅與碳粉的混合物)逐漸出現紫紅色或紅色晶體後停止加熱。
6、先撤出伸入盛有澄清石灰水的試管的玻璃導管,再撤出酒精燈。待試管冷卻後(冷卻時緒防止空氣進入試管中)將試管從鐵架台上拆卸下來,並將試管中的粉末倒在一張乾淨的白紙上,將粉末攤開後觀察。
分析與結論
在這個反應里,氧化銅失去氧而變成單質銅。這種含氧化合物里的氧被奪去的反應,叫做還原反應。其中碳是還原劑。木炭是使氧化銅還原為銅的物質,它具有還原性。單質碳的還原性可用於冶金工業。實驗現象
黑色粉末逐漸變成光亮的紫紅色,生成氣體通入澄清的石灰水後,使澄清石灰水變渾濁。
有時會伴有暗紅色固體生成(氧化亞銅)