發現簡史
 矽
矽1787年,拉瓦錫首次發現矽存在於岩石中。
1800年,戴維將其錯認為一種化合物。
1811年蓋-呂薩克和泰納爾(Thenard, Louis Jacques)加熱鉀和四氟化矽得到不純的無定形矽,根據拉丁文silex(燧石)命名為silicon。
1811年,Gay-Lussac和Thenard以矽(矽)的四氟化物與鹼土金屬反應,發現在反應當中生成赤褐色的化合物(可能是含不純物無定形的矽)。
1823年,矽首次作為一種元素被永斯·雅各布·貝采利烏斯發現,並於一年後提煉出了無定形矽,其方法與蓋-呂薩克使用的方法大致相同。他隨後還用反覆清洗的方法將單質矽提純。
1823年,Berzelius以氧化矽(矽)的粉末,加以鐵,碳的混和物在高溫下加熱,得到矽(矽)化鐵。但是為了抽取純的矽(矽),他使用矽(矽)-氟-鈣的化合物,乾燒之後得到的固體,加水分解得到純的矽(矽)。
發現矽的榮譽歸屬於瑞典化學家Jöns Jacob Berzelius,在斯德哥爾摩(瑞典首都)於1824年,他通過加熱氟矽酸鉀和鉀獲取了矽。這個產物被矽酸鉀污染,但他把它放在水中攪拌,會與之反應,因此得到了相對純淨的矽粉末。
1824年永斯·雅各布·貝采利烏斯用同樣的方法,但經過反覆洗滌除去其中的氟矽酸,得到純無定形矽。
結晶性的矽則到了1854年才被提煉出來。矽(矽)的拉丁文是silicium,意為"堅硬之石"。
1854年H·S·C·德維爾第一次製得晶態矽。
 單晶矽及拋光矽片
單晶矽及拋光矽片矽名稱的由來:英文silicon,來自拉丁文的silex,silicis,意思為燧石(火石)。 民國初期,學者原將此元素譯為“矽”而令其讀為“xi(圭旁確可讀xi音)”(又,“矽”字本為“砉”字之異體,讀huo)。然而在當時的時空下,由於拼音方案尚未推廣普及,一般大眾多誤讀為gui。由於化學元素譯詞除中國原有命名者,多用音譯,化學學會注意到此問題,於是又創 “矽”字避免誤讀。台灣沿用“矽”字至今。中國大陸在1953年2月,中國科學院召開了一次全國性的化學物質命名擴大座談會,有學者以“矽”與另外的化學元素“錫”和“硒”同音易混淆為由,通過並公布改回原名字“矽”並讀“gui”,但並未意識到其實“矽”字本亦應讀xi音。有趣的是,矽肺與矽鋼片等辭彙至今仍用矽字。在香港,兩用法皆有,但“矽”較通用。
礦藏分布
 矽的DFT能帶結構
矽的DFT能帶結構矽的豐度,引起早期化學家的興趣。矽(矽)在地球表面的含量僅次於氧,占有將近28%.但是矽(矽)元素並非最早被發現的元素,那是因為從矽(矽)的氧化物中要將矽還原出來是一件非常困難的事。
矽約占地殼總重量的25.7%,僅次於氧。在自然界中,矽通常以含氧化合物形式存在,其中最簡單的是矽和氧的化合物矽石SiO。石英、水晶等是純矽石的變體。礦石和岩石中的矽氧化合物統稱矽酸鹽,較重要的有長石KAlSiO、高嶺土AlSiO(OH)、滑石Mg(SiO)(OH)、雲母KAl(AlSiO)(OH)、石棉HMgSiO、鈉沸石Na(AlSiO)·HO、石榴石CaAl(SiO)、鋯石英ZrSiO和綠柱石BeAlSiO等。土壤、黏土和砂子是天然矽酸鹽岩石風化後的產物。
 基於矽材料的電子產品
基於矽材料的電子產品矽在自然界分布很廣,在地殼中的原子百分含量為16.7%。是組成岩石礦物的一個基本元素,以石英砂和矽酸鹽出現。
矽在地殼中的含量是除氧外最多的元素。如果說碳是組成一切有機生命的基礎,那么矽對於地殼來說,占有同樣的位置,因為地殼的主要部分都是由含矽的岩石層構成的。這些岩石几乎全部是由矽石和各種矽酸鹽組成。長石、雲母、黏土、橄欖石、角閃石等等都是矽酸鹽類;水晶、瑪瑙、碧石、蛋白石、石英、砂子以及燧石等等都是矽石。
理化性質
物理性質
 矽原子結構三維圖
矽原子結構三維圖![矽[元素符號矽]](/img/e/867/wZwpmLyEjN5QDM5kzMzEDN0UTMyITNykTO0EDMwAjMwUzL5MzLxUzLt92YucmbvRWdo5Cd0FmL0E2LvoDc0RHa.jpg) 矽[元素符號矽]
矽[元素符號矽]有無定形矽和晶體矽兩種同素異形體。晶體矽為灰黑色,無定形矽為黑色,密度2.32-2.34克/立方厘米,熔點1410℃,沸點2355℃,晶體矽屬於原子晶體。不溶於水、硝酸和鹽酸,溶於氫氟酸和鹼液。硬而有金屬光澤。
| 系列 | 類金屬 |
| 族 | ⅣA族 |
| 周期 | 3 |
| 元素分區 | p區 |
| 密度 | 2328.3 kg/m³ |
| 常見化合價 | +4 |
| 硬度 | 6.5 |
| 地殼含量 | 25.7% |
| 彈性模量 | 190GPa(有些文獻中為這個值) |
| 密度 | 2.33g/cm³(18℃) |
| 熔點 | 1687K(1414℃) |
| 沸點 | 3173K(2900℃) |
| 摩爾體積 | 12.06×10⁻⁶m³/mol |
| 汽化熱 | 384.22kJ/mol |
| 熔化熱 | 50.55 kJ/mol |
| 蒸氣壓 | 4.77Pa(1683K) |
| 間接帶隙 | 1.1eV (室溫) |
| 電導率 | 2.52×10⁻⁴ /(米歐姆) |
| 電負性 | 1.90(鮑林標度) |
| 比熱 | 700 J/(kg·K) |
原子核外電子排布:1s²2s²2p⁶ 3s²3p²;
晶胞類型:立方金剛石型;
晶胞參數:20℃下測得其晶胞參數a=0.543087nm;
顏色和外表: 深灰色、帶藍色調;
採用納米壓入法測得單晶矽(100)的E為140~150GPa;
電導率:矽的電導率與其溫度有很大關係,隨著溫度升高,電導率增大,在1480℃左右達到最大,而溫度超過1600℃後又隨溫度的升高而減小。
| 電負性 | 1.90(鮑林標度) |
| 熱導率 | 148 W/(m·K) |
| 第一電離能 | 786.5 kJ/mol |
| 第二電離能 | 1577.1 kJ/mol |
| 第三電離能 | 3231.6 kJ/mol |
| 第四電離能 | 4355.5 kJ/mol |
| 第五電離能 | 16091 kJ/mol |
| 第六電離能 | 19805 kJ/mol |
| 第七電離能 | 23780 kJ/mol |
| 第八電離能 | 29287 kJ/mol |
| 第九電離能 | 33878 kJ/mol |
| 第十電離能 | 38726 kJ/mol |
同位素:
| 符號 | Z(p) | N(n) | 質量(u) | 半衰期 | 原子核自鏇 | 相對豐度 | 相對豐度的變化量 |
| 22Si | 14 | 8 | 22.03453(22)# | 29(2)ms | 0+ | ||
| 23Si | 14 | 9 | 23.02552(21)# | 42.3(4)ms | 3/2+# | ||
| 24Si | 14 | 10 | 24.011546(21) | 140(8)ms | 0+ | ||
| 25Si | 14 | 11 | 25.004106(11) | 220(3)ms | 5/2+ | ||
| 26Si | 14 | 12 | 25.992330(3) | 2.234(13)s | 0+ | ||
| 27Si | 14 | 13 | 26.98670491(16) | 4.16(2)s | 5/2+ | ||
| 28Si | 14 | 14 | 27.9769265325(19) | 穩定 | 0+ | 0.92223(19) | 0.92205-0.92241 |
| 29Si | 14 | 15 | 28.976494700(22) | 穩定 | 1/2+ | 0.04685(8) | 0.04678-0.04692 |
| 30Si | 14 | 16 | 29.97377017(3) | 穩定 | 0+ | 0.03092(11) | 0.03082-0.03102 |
| 31Si | 14 | 17 | 30.97536323(4) | 157.3(3)min | 3/2+ | ||
| 32Si | 14 | 18 | 31.97414808(5) | 170(13)a | 0+ | ||
| 33Si | 14 | 19 | 32.978000(17) | 6.18(18)s | (3/2+) | ||
| 34Si | 14 | 20 | 33.978576(15) | 2.77(20) s | 0+ | ||
| 35Si | 14 | 21 | 34.98458(4) | 780(120) ms | 7/2-# | ||
| 36Si | 14 | 22 | 35.98660(13) | 0.45(6)s | 0+ | ||
| 37Si | 14 | 23 | 36.99294(18) | 90(60)ms | (7/2-)# | ||
| 38Si | 14 | 24 | 37.99563(15) | 90# ms [>1 µ;s] | 0+ | ||
| 39Si | 14 | 25 | 39.00207(36) | 47.5(20) ms | 7/2-# | ||
| 40Si | 14 | 26 | 40.00587(60) | 33.0(10) ms | 0+ | ||
| 41Si | 14 | 27 | 41.01456(198) | 20.0(25) ms | 7/2-# | ||
| 42Si | 14 | 28 | 42.01979(54)# | 13(4) ms | 0+ | ||
| 43Si | 14 | 29 | 43.02866(75)# | 15# ms [>260 ns] | 3/2-# | ||
| 44Si | 14 | 30 | 44.03526(86)# | 10# ms | 0+ |
備註:1.畫上#號的數據代表沒有經過實驗的證明,只是理論推測而已,而用括弧括起來的代表數據不確定性。
2.有三種天然的穩定同位素Si(92.2%)、Si(4.7%)和Si(3.1%),還有質量數為25、26、27、31和32的人工放射性同位素。
3.矽(原子質量單位: 28.0855,共有23種同位素,其中有3種同位素是穩定的。
化學性質
 Si的熱力學數據(來源於JANAF表格)
Si的熱力學數據(來源於JANAF表格)矽有明顯的非金屬特性,可以溶於鹼金屬氫氧化物溶液中,產生(偏)矽酸鹽和氫氣。
矽原子位於元素周期表第IV主族,它的原子序數為Z=14,核外有14個電子。電子在原子核外,按能級由低矽原子到高,由里到外,層層環繞,這稱為電子的殼層結構。矽原子的核外電子第一層有2個電子,第二層有8個電子,達到穩定態。最外層有4個電子即為價電子,它對矽原子的導電性等方面起著主導作用。
正因為矽原子有如此結構,所以有其一些特殊的性質:最外層的4個價電子讓矽原子處於亞穩定結構,這些價電子使矽原子相互之間以共價鍵結合,由於共價鍵比較結實,矽具有較高的熔點和密度;化學性質比較穩定,常溫下很難與其他物質(除氟化氫和鹼液以外)發生反應;矽晶體中沒有明顯的自由電子,能導電,但導電率不及金屬,且隨溫度升高而增加,具有半導體性質。
加熱下能同單質的鹵素、氮、碳等非金屬作用,也能同某些金屬如Mg、Ca、Fe、Pt等作用。生成矽化物。不溶於一般無機酸中,可溶於鹼溶液中,並有氫氣放出,形成相應的鹼金屬矽酸鹽溶液,於赤熱溫度下,與水蒸氣能發生作用。
分類:純淨物、單質、非金屬單質。
(1)與單質反應:
Si + O₂ == SiO₂,條件:加熱
Si + 2F₂ == SiF₄
Si + 2Cl₂ == SiCl₄,條件:高溫
(2)高溫真空條件下可以與某些氧化物反應:
2MgO + Si=高溫真空 =Mg(g)+SiO₂(矽熱還原法煉鎂)
(3)與酸反應:
只與氫氟酸反應:Si + 4HF == SiF₄↑ + 2H₂↑
(4)與鹼反應:Si + 2OH ⁻+ H₂O == SiO₃²⁻+ 2H₂↑(如NaOH,KOH)
注意:矽、鋁是既能和酸反應,又能和鹼反應,放出氫氣的單質。
相關方程式:
Si+O₂=高溫= SiO₂
Si + 2OH⁻ + H₂O == SiO₃²⁻+ 2H₂↑
Si+2F₂== SiF₄
Si+4HF== SiF₄↑+2H₂↑
SiO₂ + 2OH⁻== SiO₃²⁻+ H₂O
SiO₃²⁻+ 2NH₄⁺+ H₂O == H₄SiO₄↓ + 2NH₃↑
SiO₃²⁻+ CO₂ + 2H₂O == H₄SiO₃↓+ CO₃²⁻
SiO₃²⁻+ 2H⁺== H₂SiO₃↓
SiO₃²⁻+2H⁺+H₂O == H₄SiO₄↓
H₄SiO₄ == H₂SiO₃ + H₂O
3SiO₃²⁻+ 2Fe³⁺== Fe₂(SiO₃)₃↓
3SiO₃²⁻+2Al³⁺==Al₂(SiO₃)₃↓
Na₂CO₃ + SiO₂ =高溫= Na₂SiO₃ + CO₂ ↑
相關化合物:
二氧化矽、矽膠、矽酸鹽、矽酸、原矽酸、矽烷、二氯矽烷、三氯矽烷、四氯矽烷、
原子屬性:
原子量:28.0855u;
原子核虧損質量:0.1455u;
原子半徑:(計算值)110(111)pm;
共價半徑:111 pm;
范德華半徑:210 pm;
外圍電子層排布:3s²3p²;引
電子在每個能級的排布:2,8,4;
電子層:KLM;
氧化性(氧化物):4(兩性的)。
製取方法
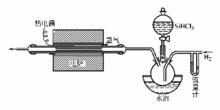 矽的製取裝置
矽的製取裝置實驗室里可用鎂粉在赤熱下還原粉狀二氧化矽,用稀酸洗去生成的氧化鎂和鎂粉,再用氫氟酸洗去未作用的二氧化矽,即得單質矽。這種方法製得的都是不夠純淨的無定形矽,為棕黑色粉末。工業上生產矽是在電弧爐中還原矽石(SiO含量大於99%)。使用的還原劑為石油焦和木炭等。使用直流電弧爐時,能全部用石油焦代替木炭。石油焦的灰分低(0.3%~0.8%),採用質量高的矽石(SiO大於99%),可直接煉出製造矽鋼片用的高質量矽。高純的半導體矽可在1,200℃的熱矽棒上用氫氣還原高純的三氯氫矽SiHCl或SiCl製得。超純的單晶矽可通過直拉法或區域熔煉法等製備。
用鎂還原二氧化矽可得無定形矽。用碳在電爐中還原二氧化矽可得晶體矽。電子工業中用的高純矽則是用氫氣還原三氯氫矽或四氯化矽而製得。
套用領域
 矽晶圓片
矽晶圓片1、高純的單晶矽是重要的半導體材料。在單晶矽中摻入微量的第IIIA族元素,形成p型矽半導體;摻入微量的第VA族元素,形成n型半導體。p型半導體和n型半導體結合在一起形成p-n結,就可做成太陽能電池,將輻射能轉變為電能。在開發能源方面是一種很有前途的材料。另外廣泛套用的二極體、三極體、晶閘管、場效應管和各種積體電路(包括人們計算機內的晶片和CPU)都是用矽做的原材料。
2、金屬陶瓷、宇宙航行的重要材料。將陶瓷和金屬混合燒結,製成金屬陶瓷複合材料,它耐高溫,富韌性,可以切割,既繼承了金屬和陶瓷的各自的優點,又彌補了兩者的先天缺陷。可套用于軍事武器的製造。第一架太空梭“哥倫比亞號”能抵擋住高速穿行稠密大氣時摩擦產生的高溫,全靠它那三萬一千塊矽瓦拼砌成的外殼。
3、光導纖維通信,最新的現代通信手段。用純二氧化矽可以拉制出高透明度的玻璃纖維。雷射可在玻璃纖維的通路里,發生無數次全反射而向前傳輸,代替了笨重的電纜。光纖通信容量高,一根頭髮絲那么細的玻璃纖維,可以同時傳輸256路電話;而且它還不受電、磁的干擾,不怕竊聽,具有高度的保密性。光纖通信將會使21世紀人類的生活發生革命性巨變。
4、性能優異的矽有機化合物。例如有機矽塑膠是極好的防水塗布材料。在地下鐵道四壁噴塗有機矽,可以一勞永逸地解決滲水問題。在古文物、雕塑的外表,塗一層薄薄的有機矽塑膠,可以防止青苔滋生,抵擋風吹雨淋和風化。天安門廣場上的人民英雄紀念碑,便是經過有機矽塑膠處理表面的,因此永遠潔白、清新。
5、由於有機矽獨特的結構,兼備了無機材料與有機材料的性能,具有表面張力低、粘溫係數小、壓縮性高、氣體滲透性高等基本性質,並具有耐高低溫、電氣絕緣、耐氧化穩定性、耐候性、難燃、憎水、耐腐蝕、無毒無味以及生理惰性等優異特性,廣泛套用於航空航天、電子電氣、建築、運輸、化工、紡織、食品、輕工、醫療等行業,其中有機矽主要套用於密封、粘合、潤滑、塗層、表面活性、脫模、消泡、抑泡、防水、防潮、惰性填充等。隨著有機矽數量和品種的持續增長,套用領域不斷拓寬,形成化工新材料界獨樹一幟的重要產品體系,許多品種是其他化學品無法替代而又必不可少的。
6、矽可以提高植物莖稈的硬度,增加害蟲取食和消化的難度。儘管矽元素在植物生長發育中不是必需元素,但它也是植物抵禦逆境、調節植物與其他生物之間相互關係所必需的化學元素。
矽在提高植物對非生物和生物逆境抗性中的作用很大,如矽可以提高植物對乾旱、鹽脅迫、紫外輻射以及病蟲害等的抗性。矽可以提高水稻對稻縱卷葉螟的抗性,施用矽後水稻對害蟲取食的防禦反應迅速提高,矽對植物防禦起到警備作用。
水稻在受到蟲害襲擊時,矽可以警備水稻迅速激活與抗逆性相關的茉莉酸途徑,茉莉酸信號反過來促進矽的吸收,矽與茉莉酸信號途徑相互作用影響著水稻對害蟲的抗性。
生理功能
 單晶矽棒
單晶矽棒矽是人體必需的微量元素之一。占體重的0.026%。矽及含矽的粉塵對人體最大的危害是引起矽肺。矽肺是嚴重的職業病之一,礦工、石材加工工人以及其他在含有矽粉塵場所的工人應採取必要的防護措施。
矽在結締組織、軟骨形成中矽是必需的,矽能將粘多糖互相連結,並將粘多糖結合到蛋白質上,形成纖維性結構,從而增加結締組織的彈性和強度,維持結構的完整性;矽參與骨的鈣化作用,在鈣化初始階段起作用,食物中的矽能增加鈣化的速度,尤其當鈣攝入量低時效果更為明顯;膠原中胺基酸約21%為羥脯氨酸,脯氨醯羥化酶使脯氨酸羥基化,此酶顯示最大活力時需要矽;通過對不同來源的膠原分析,結果顯示矽是膠原組成成分之一。
參考攝入量:由於沒有人體矽需要量的實驗資料,因此難以提出合適的人體每日矽的需求量,由動物實驗推算,矽若易吸收,每天人體的需要量可能為2~5mg。但膳食中大部分的矽不易被吸收,推薦攝入量每天約為5~10mg,可以認為每日攝入20~50mg是適宜的。
過量表現:高矽症,高矽飲食的人群中曾發現局灶性腎小球腎炎,腎組織中含矽量明顯增高的個體。也有報導有人大量服用矽酸鎂(含矽抗酸劑)可能誘發人類的尿路結石。
矽肺病,經呼吸道長期吸入大量含矽的粉塵,可引起矽肺。
 矽單晶懸浮區熔爐
矽單晶懸浮區熔爐矽肺(silicosis)又稱矽肺,是塵肺中最為常見的一種類型,是由於長期吸入大量含有游離二氧化矽粉塵所引起,以肺部廣泛的結節性纖維化為主的疾病。矽肺病人由於兩肺發生廣泛性纖維組織增生肺組織的微血管循環受到障礙,抵抗力下降,因而容易合併其他疾病,導致病情惡化,甚至死亡。
不足表現:飼料中缺少矽可使動物生長遲緩、缺乏導致頭髮、指甲易斷裂,皮膚失去光澤。動物試驗結果顯示,餵飼致動脈硬化飲料的同時補充矽,有利於保護動物的主動脈的結構。另外,已確定血管壁中矽含量與人和動物粥樣硬化程度呈反比。在心血管疾病長期發病率相差兩部的人群中,其飲用水中矽的含量也相差約兩倍,飲用水矽含量高的人群患病較少。
矽是一種非常安全的物質,本身不予免疫系統反應,也不會被細胞吞噬,更不會滋生細菌或與化學物質發生反應,同時還可以有針對皮膚傷口所開發生產的矽膠,可以用來保護傷口,是安全性非常高的材料,受各國衛生機關許可使用。
常見謠言
謠言:在自然界中,矽都以含氧化合物形式存在。
駁斥:自然界存在天然的矽單質且早有報導,下為文獻報導節選
本文對自然矽進行了礦相學、礦物學研究。該礦物產於福建某地矽卡岩型硫、多金屬礦床中。自然矽呈亮灰銀白色、強金屬光澤。性脆。鏡下呈渾圓粒狀、乳滴狀。均質。實測比重d=2.368。硬度H_M=6.76。反射率 R 470nm 37.08;546nm 33.44;589nm 31.27;650nm 29.96。經掃描電鏡能譜分析、電子探針分析,Si 99.87%~99.94%。
