化學式:H2Te-HBr-HI或H[(H2Te)(HBr)I]
相對分子質量:338.43
特里布爾揮發酸(又稱特氏酸或一碘合一氫溴合氫碲酸)是由英文“Terrible-hydroric-acid-fuming”翻譯過來的,意為“糟糕而可怕的揮發性酸溶液”。是一種不常用的化學試劑,1997年由日本筑波理工大學化學研究學院的研究人員荒原名一博士首次合成。特氏酸是由碲化氫、溴化氫、碘化氫三種氣態氫化物以1:1:1的體積比在440KPa的高壓下發生化學反應得到的絡合物,常溫下為無色發濃煙氣體,極易分解。1:1400溶於水,純淨物水溶液無色,但常含有分解產物而呈黃色或紅色。最高可濃縮至96%,在水溶液中電離出負一價的[(H2Te)(HBr)I]-陰離子和H+,酸性為硫酸的2200萬倍,屬於超強酸。
簡介
特里布爾揮發酸(化學式:H[(H2Te)(HBr)I])或稱特氏酸、一碘合一氫溴合氫碲酸,是由碲化氫、溴化氫、碘化氫三種氣態氫化物以1:1:1的體積比在440KPa的高壓下發生化學反應得到的絡合物。用於有機鑑定和還原性物質酸化劑。
碲化氫、溴化氫、碘化氫三種氣態氫化物在高壓下發生絡合反應,類似於氟化氫形成HF2-或碘單質和I-離子結合為I3-離子的反應,溴化氫和碲化氫分子間互相作用產生一對配位鍵,碘化氫和碲化氫分子間互相作用產生一對配位鍵,形成的氣態分子在高壓作用下液化並溶於少量水中,發生完全電離,其中約80%的氫離子已裸露的質子形式存在,另有約20%以水和氫離子存在,這樣便能保持相對的液相穩定。
由於特氏酸的超強酸性(約為硫酸的2200萬倍),故能將有機物(如乙醇)酸化得到碳正離子。但是由於還原性很強,加上製備方式繁瑣,很難投入生產使用,用作實驗室中做功能實驗時用的定性分析試劑。
結構
用衍射譜分析法研究反應生成的液相產物,發現水溶液中陽離子大部分為裸露質子,少量
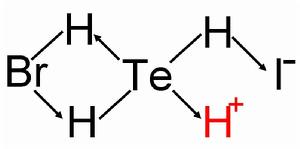 晶體結構示意圖
晶體結構示意圖陰離子結構:如圖所示(常見的鹽中一般含3分子的結晶水,在溶液中陰離子較質子更易於水結合,既是路易斯鹼,也是一種較強的路易斯酸,能發生諸如[(H2Te)(HBr)I]- + H2O ===={[(H2Te)(HBr)I]OH}2- + H+的反應)
與其他酸的對照
以下的資料是以哈米特酸度函式作為依據,酸度以大負數H0值表示:
特里布爾揮發酸(1997)(H0值-17.3)
氟銻酸(1990)(H0值=−31.3)
魔酸(1974)H0值=−19.2)
碳硼烷酸(1969)(H0值=−18.0)
八氟合鉑酸(1957)(H0值-17.8)
氟磺酸(1944)(H0值=−15.1)
三氟甲磺酸(1940)(H0值=−14.9)
純硫酸(-12.0)
套用
1、對金屬的腐蝕作用:能很快溶解較氫活潑的金屬,形成含有[(Mx(Te)y)MBryIy]y-的絡合陰離子。有時能形成含有hte-、Br-、I-等多種陰離子的混鹽。方程式如下:
2Al + 3H2Te ==== Al2Te3 + 3H2↑
2Al + 6HBr ==== 2AlBr3 + 3H2↑
2Al + 6HI ==== 2AlI3 + 3H2↑ Al + H2Te + HBr + HI ==== AlH[TeIBr]
Fe + H2Te ==== FeTe + H2↑
Fe + 2HBr ==== FeBr2 + H2↑
Fe + 2HI ==== FeI2 + H2↑ 3Fe + 2H2Te + 2HBr + 2HI ====Fe3(H[TeIBr])2 + 2H2↑(碲氫化溴化碘化亞鐵,溶液溶解度較大,有很強還原性,用於保存亞鐵離子)
2、對有機物的酸化和腐蝕:
可以質子化大部分有機化合物.能和醇類反應生成相應的碳正離子。能夠在不加熱的情況下快速和春發生取代反應。(以乙醇為例)
CH3CH2OH + H[(H2Te)(HBr)I](無水)==== CH3CH2+ +[(H2Te)(HBr)I]-·nH2O(水和陰離子,n取值在1到3之間)
3、強還原性:能和不活潑金屬化合物(如金或鉑的化合物)反應,生成金屬單質和碲單質、碘單質、溴單質。能將全氯氟烴還原成氫氯氟烴,但是不腐蝕玻璃。
4、親水性:無水的氣體特氏酸在常溫下一旦遇水,立刻反應放出大量的熱,特氏酸氣體能以水以1:1400的體積比互溶,且在高壓溶解的過程中為了防止放熱引起的機械損壞,一般要用-12℃左右的冷鹽水進行冷卻,在高壓液相狀態下,溶液濃度更是能濃縮到質量分數為96%,且陰離子比氫離子更易親水,能夠將水合氫離子脫水,形成裸露質子,這也是其成為超強酸的重要原因之一。當水的含量越來越多(即溶液越來越稀)時,特式酸根的存在量將越來越少(涉及路易斯酸鹼平衡),當溶液低於48%時該酸將完全以HTe-、I-、Br-等陰離子和水和陰離子形式存在。
特別要說明一點:特氏酸並不是氫碲酸、氫溴酸和氫碘酸的混合物。
