原理
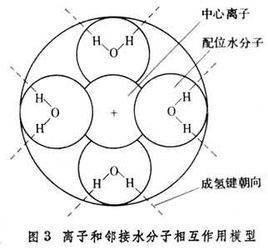
以水溶液為例,其中一個離子周圍水的結構模型如圖所示。
圖中:A為化學水化層,該層中由於離子和水偶極子的強大電場作用,使得水分子與離子結合牢固,因而失去平動自由度,這一層水分子和離子一塊移動,且水分子數不受溫度影響,一般形成配位鍵;
B為物理水化層,該層水分子也受到離子的吸引,但由於距離較遠,吸引較弱,水分子數隨溫度改變;
C為自由水分子層,該層水分子不受離子電場影響。
對廣義的溶劑,根據Lewis酸鹼反應,電子的接受體和給出體相互之間發生酸鹼反應,它們相互之間作用力強,有利於互相均勻混合。
分類
以水溶液為例,水分子的兩種溶劑化作用
水分子受離子靜電的作用而定向在離子周圍形成水化殼,這是水的第一種
 溶劑化作用
溶劑化作用溶劑化作用——離子水化;水分子還可使在純態時由不導電的電解質變成導電的電解質,這是水的第二種溶劑化作用。
對廣義的溶劑,第一類溶劑有很弱的親電子性質,即很弱的氫鍵受體,因為C的電負性稍大於氫;
第二類為給電子性溶劑,是氫鍵接受體,因為該類溶劑中都帶有能給出孤電子對的氧;
第三類溶劑有羥基,是氫鍵接受體和氫鍵給出體,能夠形成強的氫鍵。
當滿足溶解度參數的要求是,第三類溶劑可以溶解第二類聚合物,這是因為溶劑和高分子之間存在溶劑化作用或氫鍵。第二類溶劑可以溶解第一類和第三類聚合物。而第二類溶劑不易溶解第二類聚合物,但含有酯基的有可能相互溶解,因為酯基是兩性偶極基團。第一類溶劑不易溶解第一類聚合物。第三類溶劑與第三類高分子因相互之間能夠形成氫鍵可溶解。
靜態模擬
通常我們對溶劑效應的靜態模擬,關心的是溶劑效應的兩個方面:一是溶劑分子反應中心有鍵的作用,包括配位鍵和氫鍵等,這種作用屬於短程作用,另一個是極性溶劑的偶極距和溶質分子偶極距之間的靜電相互作用,這個屬於遠程作用,當然溶劑和溶質之間的色散力作用也是重要的遠程作用,特別是對於非極性溶劑而言,但是色散力的描述是量子化學模擬的一個難題。
考慮溶劑效應,可以採用三種策略:1. 對於短程作用十分重要的體系,我們採用microsolvation model,或者稱為 explicit Solvation model。直接考慮溶劑分子和反應中心的作用。2. 對於沒有短程作用的體系,我們直接用虛擬溶劑模型(Implicit Solvation Model)來模擬遠程作用。這種虛擬溶劑模型通常是把溶劑效應看成是溶質分子分布在具有均一性質的連續介質(Continuum)當中,也稱為反應場(Reaction Field)。3. 短程作用的microsolvation model和遠程作用的連續介質(Continuum)模型結合起來的方法漸漸為人們所青睞。這種方法得到的結果更為可靠,因為它綜合考慮的溶劑的短程作用和遠程作用。
短程作用的模擬,很直觀的直接採用QM的方法研究溶劑分子作用了的活性中心,考慮這種成鍵對反應區域和反應過渡態結構和能量的影響。遠程作用需要做一些物理上的近似處理(也就是一定的物理模型)。連續介質(Continuum)模型有很多,作為常用的是PCM (極化連續介質模型,Polarized Continuum Model)。其他一些常用的連續介質模型還包括Onsager, COSMO, SMx等等。PCM最早於1981年由Tomasi教授(義大利比薩大學)提出。
涉及到三個概念cavity formation, dispersion-repulsion 和electrostatic interaction。在連續的介質中騰出空穴(cavity)以容納溶質,會導致體系能量升高,這部分的能量稱為cavity formation energy。空穴中的溶質和溶劑的作用,主要是范德華力的作用 (不包括靜電作用)。這部分能量稱為分散-排斥能(dispersion-repulsion energy),一般為負值(能量降低)。溶質分子的電荷分布會通過靜電作用使連續介質(溶劑)產生極化,而溶劑的極化作用反過來又會影響到溶質分子的電荷分布。這就是靜電的相互作用(electrostatic energy),使體系能量降低。三項能量的加和得到了溶劑化自由能(free energy of solvation),前兩項的能量與空穴表面積接近成正比關係,在PCM模型中,這兩項能量由表面積結合一些與原子特性相關的半經驗參數計算而得。
為了提高PCM計算的精確度,PCM模型中的半經驗參數和物理近似一直在改進,
DPCM(Dielectric PCM,極化絕緣連續介質模型),也就是Tomasi提出的原始PCM模型。
IPCM (Isodensity Su***ce PCM, 等密度表面極化連續介質模型)
IPCM採用分子的等(電子)密度面作為空穴(例如電子密度為0.001的表面),同樣進行自洽反應場疊代,直至等密度面不再變化為止。
SCIPCM (Self-Consistent Isodensity Su***ce PCM,自洽等密度表面極化連續介質模型)
SCIPCM同樣採用分子的等(電子)密度面作為空穴,與IPCM不同的是SCIPCM除了考慮靜電效應對等密度面的影響之外,還將體系總能量(包括溶解能)包括進來,以最佳化到具有最低能量的等密度面。因為由於等密度面(空穴)的變化會影響cavity formation energy和dispersion-repulsion energy,所以把這兩項因素加入疊代是很有必要的。
CPCM或COSMO (COnductor-like Screening MOdel)
和典型的PCM不同,CPCM或者COSMO採用原子電荷而不是電子密度來計算靜電勢。由於採用了這個近似,雖然計算速度快很多,但精度也有所降低。
IEFPCM (PCM using the Intergral Equation Formalism model)
使用不同數學模型的PCM模型,可以計算在各項異性介質(例如液晶)或非絕緣溶液(離子溶液)中的溶劑效應。是Gaussian 03的默認方法。
Pratt, L. M.; Nguyen, N. V.; Le, L. T. J. Org. Chem. 2005, 70, 2294-2298.
從實驗角度而言,溶劑效應主要體現在兩個方面,一是溶劑分子與溶質的絡合或者氫鍵等分子間弱相互作用(有時稱為“短程”作用),二是極性溶劑通過靜電作用對溶質分子電荷分布的影響(“遠程”作用)。
對於第一種“短程”作用的理論計算,往往需要運用“真實溶劑模型”(Explicit Solvation Model),即考慮多個溶劑分子與溶質的相互作用,因為這種作用經常由很多不同構型的弱相互作用絡合體貢獻而得,這種模型的具體套用往往需要結合了蒙特卡羅或分子動力學等方法。對於第二種“遠程”作用,通常需要採用“虛擬溶劑模型”(Implicit Solvation Model)來計算。進入21世紀後比較流行的處理方法是引用“反應場”(Reaction Field)的概念,把溶劑效應看成是溶質分子分布在具有均一性質的連續介質(Continuum)當中。而這種連續介質模型又包含很多分支,PCM (極化連續介質模型,Polarized Continuum Model)就是最常用的分支之一。
