作用
抗凝血酶I(AT I)在凝血酶激活纖維蛋白原轉化為纖維蛋白後使之附著於新形成的纖維蛋白上(理論上可中和過量凝血酶,緩解血管內凝血)。抗凝血酶II(AT II)是一種血漿中的輔助因子,配合肝素共同作用,干擾凝血酶與纖維蛋白原的相互作用。抗凝血酶IV(AT IV)是一種在凝血過程中和之後短暫時間內被激活的一種抗凝血酶。只有抗凝血酶III(有可能還有凝血酶I)在臨床上是有意義的。通常也常以抗凝血酶代指抗凝血酶III,本詞條中也主要介紹抗凝血酶III。
結構
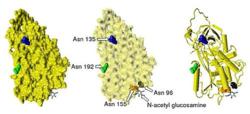 Beta-抗凝血酶,示未被占據的糖基化位點
Beta-抗凝血酶,示未被占據的糖基化位點抗凝血酶在血漿中的半衰期為大約3天。抗凝血酶在正常人類血漿中濃度約為0.12毫克/毫升,即約2.3μM。抗凝血酶已經被從人類以外的大量物種中分離取得,蛋白質和cDNA測序結果顯示,測序、牛、羊、兔和老鼠的抗凝血酶胺基酸鏈的長度均為433個殘基,超過人類的抗凝血酶一個胺基酸殘基,這個額外的胺基酸殘基被認為出現在第六位的胺基酸殘基位點上。牛,羊,兔子,老鼠,和人類抗凝血酶分享84到89%的胺基酸序列的一致性。三個單體內的六個胺基酸形成二硫鍵:Cys8-Cys128,Cys21-Cys95,Cys248-Cys430。四個潛在的N-糖基化位點位於在人類抗凝血酶一級結構96、135、155和192位置處的天冬醯胺(Asn)胺基酸殘基,在其他物種的抗凝血酶中也發生於相似的位置。在主要形式的人類抗凝血酶,即α-抗凝血酶,所有這些位點都被共價粘低聚糖側鏈附著,導致這種形式的抗凝血酶的分子量達58,200。次要形勢的抗凝血酶,β-抗凝血酶(約占10%左右),其潛在的糖基化位點在135位的天冬醯胺不被占用(如圖)。