基本特點
在惰性氣體元素的原子中,電子在各個電子層中的排列,剛好達到穩定數目。因此原子不容易失去或得到電子,也就很難與其它物質發生化學反應。很難與其它物質發生化學反應,也就是這些元素的 “惰性”所在。
發現簡史
周期表中零族元素有氦、氖、氬、氪、氙和氡一共六種,它們都是氣體。六種惰性氣體元素是在1894-1900年間陸續被發現的。發現惰性氣體的主要功績應歸於英國化學家萊姆賽(Ramsay W,1852-1916)。下面我們按元素髮現的先後順序,分別簡介這六種元素的發現經過 。
氬Ar
早在1785年,英國著名科學家卡文迪什(Cavendish H,1731-1810)在研究空氣組成時,發現一個奇怪的現象。當時人們已經知道空氣中含有氮、氧、二氧化碳等,卡文迪什把空氣中的這些成分除盡後,發現還殘留少量氣體,這個現象當時並沒有引起化學家們應有的重視。誰也沒有想到,就在這少量氣體裡竟藏著一個化學元素家族。
100多年後,英國物理學家瑞利(Rayleigh J W S,1842-1919)在研究氮氣時發現從氮的化合物中分離出來的氮氣每升重1.2508g,而從空氣中分離出來的氮氣在相同情況下每升重1.2572g,這0.0064g的微小差別引起了瑞利的注意。他與化學家萊姆賽合作,把空氣中的氮氣和氧氣除去,用光譜分析鑑定剩餘氣體,終於在1894年發現了氬。由於氬和許多試劑都不發生反應,極不活潑,故被命名為Argon,即“不活潑”之意。中譯名為氬,化學符號為Ar。
氦He
早在1868年,法國天文學家簡森(Janssen P J C,1824-1907)在觀察日全蝕時,就曾在太陽光譜上觀察到一條黃線D,這和早已知道的鈉光譜的D1和D2兩條線不相同。同時,英國天文學家洛克耶爾(Lockyer J N,1836-1920)也觀測到這條黃線D。當時天文學家認為這條線只有太陽才有,並且還認為是一種金屬元素。所以洛克耶爾把這個元素取名為Helium,這是由兩個字拼起來的,helio是希臘文太陽神的意思,後綴-ium是指金屬元素而言。中譯名為氦。
1895年,萊姆賽和另一位英國化學家特拉弗斯(Travers M W,1872-1961)合作,在用硫酸處理瀝青鈾礦時,產生一種不活潑的氣體,用光譜鑑定為氦,證實了氦元素也是一種稀有氣體,這種元素地球上也有,並且是非金屬元素。
氪Kr、氖Ne、氙Xe
由於氦和氬的性質非常相近,而且它們與周期系中已被發現的其它元素在性質上有很大差異,萊姆賽根據周期系的規律性,推測出氦和氬可能是另一族元素,在它們之間一定有一個性質和氦、氬相近的家族。果然,在1898年5月30日萊姆賽和特拉弗斯在大量液態空氣蒸發後的殘餘物中,用光譜分析首先發現了比氬重的氪,他們把它命名為Krypton,即隱藏之意。隱藏於空氣中多年才被發現。
1898年6月,萊姆賽和特拉弗斯在蒸發液態氬時收集了最先逸出的氣體,用光譜分析發現了比氬輕的氖。他們把它命名為neon,源自希臘詞neos,意為新,即從空氣中發現的新氣體。中譯名為氖。也就是現在氖燈里的氣體。
1898年7月12日,萊姆賽和特拉弗斯在分餾液態空氣,製得了氪和氖後,又把氪反覆地分次萃取,從其中又分出一種質量比氪更重的新氣體,他們把它命名為Xenon,源自希臘文xenos,意為陌生人,即為人們所生疏的氣體,因為它在空氣中的含量極少,僅占總體積的一億分之八 。
氡Rn
氡是一種具有天然放射性的稀有氣體,它是鐳、釷和錒這些放射性元素在蛻變過程中的產物,因此,只有這些元素髮現後才有可能發現氡。
1899年,英國物理學家歐文斯(Owens R B)和盧瑟福(Rutherford E,1871-1937)在研究釷的放射性時發現釷射氣,即氡-220。1900年,德國人道恩(Dorn F E)在研究鐳的放射性時發現鐳射氣,即氡-222。1902年,德國人吉賽爾(Giesel F O,1852-1927)在錒的化合物中發現錒射氣,即氡-219。直到1908年,萊姆賽確定鐳射氣是一種新元素,和已發現的其它稀有氣體一樣,是一種化學惰性的稀有氣體元素。其它兩種射氣,是它的同位素。1923年國際化學會議上命名這種新元素為radon,中文音譯成氡,化學符號為Rn。
至此,氦、氖、氬、氪、氙、氡六種稀有氣體作為一個家族全被發現了,它們占據了元素周期表零族的位置。這個位置相當特殊,在它前面是電負性最強的非金屬元素,在它後面是電負性最小的金屬活潑性最強的金屬元素。由於這六種氣體元素的化學惰性,很久以來,它們被稱為"隋性氣體"。
人類的認識是永無止境的,經過實踐的檢驗,理論的相對真理性會得到發展和完善。1962年,在加拿大工作的英國青年化學家巴特列特(Bartlett N,1932~)首先合成出第一個惰性氣體的化合物──六氟合鉑酸氙Xe[PtF6],動搖了長期禁錮人們思想。"隋性氣體"也隨之改名"稀有氣體" 。
物理化學性質
物理性質
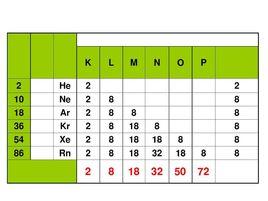
由於稀有氣體無極性且相對分子質量較小,因而它們的分子間作用力非常弱,所以熔點和沸點非常低。它們在標準狀況下都是單原子氣體,甚至比一般固體元素原子量更大的氙、氡等也是這樣。氦與其它稀有氣體元素相比,具有一些獨特的性質:它的沸點和熔點低於其它任何已知的物質;它是唯一的一種表現出超流性的元素;它是唯一不能在標準狀況下冷卻凝固的元素-必須在0.95K(−272.200℃)的溫度施加25個大氣壓(2,500kPa)的壓力,才能使它凝固。到氙為止的稀有氣體都有多個穩定的同位素,氡則沒有穩定同位素。它壽命最長的同位素222Rn的半衰期也只有3.8天,氡會衰變為氦和釙,最終衰變產物則是鉛。
稀有氣體原子像大部分族中的原子一樣,由於電子層數的增加,原子半徑隨著周期的增加而增加。原子的大小與影響物質的許多性質。例如,電離能隨著半徑的增加而減少,因為較重的稀有氣體中的價電子離核較遠,因此更容易脫離原子核的束縛。稀有氣體的電離能是每一個周期中最大的,這反映了它們的電子排布的穩定性,也導致了它們的化學性質不活潑。然而,有些較重的稀有氣體的電離能較小,足以與其它元素和分子相比。巴特利特正是看到了氙的第一電離能與氧分子相似,而嘗試用六氟化鉑來把氙氧化,因為六氟化鉑的氧化性非常強,足以把氧氣氧化。稀有氣體不能得到一個電子,而形成穩定的陰離子;也就是說,它們的電子親合能是負值
稀有氣體的巨觀物理性質主要來自原子之間的弱范德華力。原子之間的吸引力隨著原子大小的增加而增加,由於極化性的增加以及電離能的減少。這就是在第18族從上到下,原子半徑和原子間力增加,導致熔點、沸點、汽化熱和溶解度增加的原因。密度的增加則是由於原子序數的增加。
稀有氣體在標準狀況下幾乎是理想氣體,但它們與理想氣體狀態方程的偏差提供了分子間作用力的研究的重要線索。蘭納-瓊斯勢,通常用來模擬分子間的作用,由約翰·蘭納-瓊斯根據氬的實驗數據提出,那時量子力學還沒有發展到可以作為從第一性原理(即量子化學從頭計算)理解分子間作用力的工具。這些作用的理論分析變得易於處理,因為稀有氣體是單原子,且原子是球形,這意味著原子之間的作用與方向無關(各向同性)。
化學性質
稀有氣體的化學性質是由它的原子結構所決定的。
除氦以外,稀有氣體原子的最外電子層都是由充滿的ns和np軌道組成的,它們都具有穩定的8電子構型。稀有氣體的電子親合勢都接近於零,與其它元素相比較,它們都有很高的電離勢。因此,稀有氣體原子在一般條件下不容易得到或失去電子而形成化學鍵。表現出化學性質很不活潑,不僅很難與其它元素化合,而且自身也是以單原子分子的形式存在,原子之間僅存在著微弱的范德華力(主要是色散力)。
稀有氣體的熔、沸點都很低,氦的沸點是所有單質中最低的。它們的蒸發熱和在水中的溶解度都很小,這些性質隨著原子序數的增加而逐漸升高。
稀有氣體的原子半徑都很大,在族中自上而下遞增。應該注意的是,這些半徑都是未成鍵的半徑,應該僅把它們與其它元素的范德華半徑進行對比,不能與共價或成鍵半徑進行對比。
氦是所有氣體中最難液化的,溫度在2.2K以上的液氦是一種正常液態,具有一般液體的通性。溫度在2.2K以下的液氦則是一種超流體,具有許多反常的性質。例如具有超導性、低粘滯性等。它的粘度變得為氫氣粘度的百分之一,並且這種液氦能沿著容器的內壁向上流動,再沿著容器的外壁往下慢慢流下來。這種現象對於研究和驗證量子理論很有意義。
| 性質 | 氦 | 氖 | 氬 | 氪 | 氙 | 氡 |
| 密度(g/L) | 0.1786 | 0.9002 | 1.7818 | 3.708 | 5.851 | 9.97 |
| 沸點(K) | 4.4 | 27.3 | 87.4 | 121.5 | 166.6 | 211.5 |
| 熔點(K) | 0.95 | 24.7 | 83.6 | 115.8 | 161.7 | 202.2 |
| 沸點和熔點的差距 (K) | 3.45 | 2.6 | 3.8 | 5.7 | 4.9 | 9.3 |
| 汽化熱(kJ/mol) | 0.08 | 1.74 | 6.52 | 9.05 | 12.65 | 18.1 |
| 20°C時在水中的溶解度(cm/kg) | 8.61 | 10.5 | 33.6 | 59.4 | 108.1 | 230 |
| 原子序數 | 2 | 10 | 18 | 36 | 54 | 86 |
| 原子半徑(pm) | 130 | 160 | 192 | 198 | 218 | – |
| 電離能(kJ/mol) | 2372 | 2080 | 1520 | 1351 | 1170 | 1037 |
| 電負性 | 4.16 | 4.79 | 3.24 | 2.97 | 2.58 | - |
套用情況
隨著工業生產和科學技術的發展,稀有氣體越來越廣泛地套用在工業、醫學、尖端科學技術以至日常生活里。
利用稀有氣體極不活動的化學性質,有的生產部門常用它們來作保護氣。例如,在焊接精密零件或鎂、鋁等活潑金屬,以及製造半導體電晶體的過程中, 常用氬作保護氣。原子能反應堆的核燃料鈽,在空氣里也會迅速氧化,也需要在氬氣保護下進行機械加工。電燈泡里充氬氣可以減少鎢絲的氣化和防止鎢絲氧化,以延長燈泡的使用壽命。氦是氣相色譜法中的載色劑、溫度計的填充氣,並用於蓋革計數器和氣泡室等輻射測量設備中。氦和氬都用作焊接電弧的保護氣和賤金屬的焊接及切割的惰性保護氣。它們在其他冶金過程和半導體工業中矽的生產中同樣有著廣泛套用。
稀有氣體通電時會發光。世界上第一盞霓虹燈是填充氖氣製成的(霓虹燈的英文原意是“氖燈”)。氖燈射出的紅光,在空氣里透射力很強,可以穿過濃霧。因此,氖燈常用在機場、港口、水陸交通線的燈標上。燈管里充入氬氣或氦氣,通電時分別發出淺藍色或淡紅色光。有的燈管里充入了氖、氬、氦、水銀蒸氣等四種氣體(也有三種或兩種的)的混合物。由於各種氣體的相對含量不伺,便製得五光十色的各種霓虹燈。人們常用的螢光燈,是在燈管里充入少量水銀和氬氣,並 在內壁塗螢光物質(如鹵磷酸鈣)而製成的。通電時,管內因水銀蒸氣放電而產生紫外線,激發螢光物質,使它發出近似日光的可見光,所以又叫做日光燈。氪可降低燈絲的蒸發率而常用於色溫和效率更高性能白熾燈,特別在鹵素燈中可將氪與少量碘或溴的化合物混合充入。氙通常用於氙弧燈,因為它們的近連續光譜與日光相似。這種燈可用於電影放映機和汽車前燈等。
利用稀有氣體可以製成多種混合氣體雷射器。氦-氖雷射器就是其中之一。氦氖混合氣體被密封在一個特製的石英管中,在外界高頻振盪器的激勵下,混合氣體的原子間發生非彈性碰撞,被激發的原子之間發生能量傳遞,進而產生電子躍遷,並發出與躍遷相對應的受激輻射波,近紅外光。氦-氖雷射器可套用於測量和通訊。稀有氣體可用於準分子雷射器,這是因為它們可形成短暫存在的電子激發態受激子(英語:excimer)。這些用於雷射器的受激子可能是稀有氣體二聚體,例如Ar2、Kr2或Xe2,更有可能是與鹵素結合的受激子,例如ArF、KrF、XeF或XeCl。[11]這些雷射器產生波長較短的紫外線,其中ArF產生的紫外線波長為193納米,而KrF為248納米。這種高頻率的雷射使高精密成像成為現實。準分子雷射有諸多工業、醫藥和科學用途。積體電路製造過程中的顯微光刻法和微製造必須用到準分子雷射。雷射手術,例如血管再成形術和眼部手術也需用到準分子雷射。
氦氣是除了氫氣以外最輕的氣體,可以代替氫氣裝在飛艇里,不會著火和發生爆炸。液態氦的沸點為-269℃,是所有氣體中最難液化的,利用液態氦可獲得接近絕對零度(-273.15℃)的超低溫。氦氣還用來代替氮氣作人造空氣,供探海潛水員呼吸,因為在壓強較大的深海里,用普通空氣呼吸,會有較多的氮氣溶解在血液里。當潛水員從深海處上升,體內逐漸恢復常壓時,溶解在血液里的氮氣要放出來形成氣泡, 對微血管起阻塞作用,引起“氣塞症”。氦氣在血液里的溶解度比氮氣小得多,用氦跟氧的混合氣體(人造空氣)代替普通空氣,就不會發生上述現象。溫度在2.2K以上的液氦是一種正常液態,具有一般液體的通性。溫度在2.2K以下的液氦則是一種超流體,具有許多反常的性質。例如具有超導性、低粘滯性等。它的粘度變得為氫氣粘度的百分之一,並且這種液氦能沿著容器的內壁向上流動,再沿著容器的外壁往下慢慢流下來。這種現象對於研究和驗證量子理論很有意義。
氬氣經高能的宇宙射線照射後會發生電離。利用這個原理,可以在人造地球衛星里設定充有氬氣的計數器。當人造衛星在宇宙空間飛行時,氬氣受到宇宙射線的照射。照射得越厲害,氬氣發生電離也越強烈。衛星上的無線電機把這些電離信號自動地送回地球,人們就可根據信號的大小來判定空間宇宙輻射帶的位置和 強度。
氪能吸收X射線,可用作X射線工作時的遮光材料。
氙燈還具有高度的紫外光輻射,可用於醫療技術方面。氙能溶於細胞質的油脂里,引起細胞的麻醉和膨脹,從而使神經末梢作用暫時停止。人們曾試用80%氙和20%氧組成的混合氣體,作為無副作用的麻醉劑。在原子能工業上,氙可以用來檢驗高速粒子、粒子、介子等的存在。
氪、氙的同位素還被用來測量腦血流量等。
氡是自然界唯一的天然放射性氣體,氡在作用於人體的同時會很快衰變成人體能吸收的氡子體,進入人體的呼吸系統造成輻射損傷,誘發肺癌。一般在劣質裝修材料中的釷雜質會衰變釋放氡氣體,從而對人體造成傷害。體外輻射主要是指天然石材中的輻射體直接照射人體後產生一種生物效果,會對人體內的造血器官、神經系統、生殖系統和消化系統造成損傷。然而,氡也有著它的用途,將鈹粉和氡密封在管子內,氡衰變時放出的α粒子與鈹原子核進行核反應,產生的中子可用作實驗室的中子源。氡還可用作氣體示蹤劑,用於檢測管道泄漏和研究氣體運動 。