定義:
任何元素的原子都由原子核和圍繞原子核運動的電子組成。這些電子按其能量的高低分層分布,具有不同的能級,因此一個原子可具有多種能級狀態。在正常狀態下,原子處於最低能態(這個能態最穩定)稱為基態。處於基態的原子稱基態原子。基態原子受到外界能量(如熱能、光能等)激發時,其外層電子吸收了一定能量而躍遷至不同的能態(這種能態稱為激發態),因此原子可能有不同的激發態,按能量的高低分別稱作第一激發態、第二激發態等。
基態與激發態 分子的內能包括整個分子的轉動能、原子核間的振動能和電子的運動能都處於最低時的分子狀態叫做基態,當分子吸收能量後,例如電子被激發後處於高能狀態,稱為激發態,通常講的激發態是指電子激發態,它是一種不穩定的分子狀態。
產生激發態的方法:
主要有:①光激發。處於基態的原子或分子吸收一定能量的光子,可躍遷至激發態,這是產生激發態的最主要方法。②放電。主要用於激勵原子,如高壓汞燈、氙弧光燈。③化學激活。某些放熱化學反應可能使電子被激發,導致化學發光。
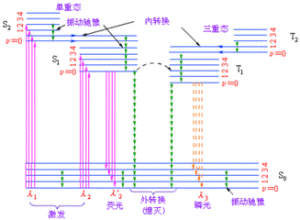
激發態去活的途徑有:
①輻射躍遷(螢光或磷光)。②無輻射躍遷(系間竄越,內部轉變)。③傳能和猝滅(激發態分子將能量傳遞給另一基態分子並使其激發)。
激發態是短壽命的,很容易返回到基態,同時放出多餘的能量。
原子基態與激發態和能量的關係:
原子在基態時能量比較低,所以運動趨勢小;在激發態時能量高,此時原子的能量積聚到將使其改變狀態。所以,物體的運動與能量有關,能量越高運動趨勢越大。
激發是在任意能級上能量的提升。在物理學中有對於這種能級有專門定義:往往與一個原子被激發至激發態有關。
在量子力學中,一個系統(例如一個原子,分子或原子核)的激發態是該系統中任意一個比基態具有更高能量的量子態(也就是說它具有比系統所能具有的最低能量要高的能量)。
一般來說,處於激發態的系統都是不穩定的,只能維持很短的時間:一個量子(例如一個光子或是一個聲子)在發生自發輻射或受激輻射後,只在能量被提升的瞬間存在,隨即返回具有較低能量的狀態(一個較低的激發態或基態)。這種能量上的衰減一般被稱為“衰變”(decay),它是“激發”的逆過程。