基本信息
遺傳病的基因治療(Gene Therapy)是指套用基因工程技術將正常基因引入患者細胞內,以糾正缺陷基因而根治疾病。糾正的途徑既可以是原位修復有缺陷的基因,也可以是用有功能的正常基因轉入細胞基因組的某一部位,以替代缺陷基因來發揮作用。基因是攜帶生物遺傳 信息的基本功能單位,是位於染色體上的一段特定序列。將外源的基因導入生物細胞內必須藉助一定的技術方法或載體,基因轉移的方法分為生物學方法、物理方法和化學方法。腺病毒載體是目前基因治療最為常用的病毒載體之一。基因治療主要是治療那些對人類健康威脅嚴重的疾病,包括:遺傳病(如血友病、囊性纖維病、家庭性高膽固醇血症等)、惡性腫瘤、心血管疾病、感染性疾病(如愛滋病、類風濕等)。基因治療是將人的正常基因或有治療作用的基因通過一定方式導入人體靶細胞以糾正基因的缺陷或者發揮治療作用,從而達到治療疾病目的的生物醫學高技術。基因治療與常規治療方法不同:一般意義上疾病的治療針對的是因基因異常而導致的各種症狀,而基因治療針對的是疾病的根源--異常的基因本身。基因治療有二種形式:一是體細胞基因治療,正在廣泛使用;二是生殖細胞基因治療,因能引起遺傳改變而受到限制。
基因治療的靶細胞主要分為兩大類:體細胞和生殖細胞,如今開展的基因治療只限於體細胞。生殖細胞的基因治療是將正常基因直接引入生殖細胞,以糾正缺陷基因。這樣,不僅可使遺傳疾病在當代得到治療,而且還能將新基因傳給患者後代,使遺傳病得到根治。但生殖細胞的基因治療涉及問題較多,技術也較複雜,因此,如今更多地是採用體細胞基因治療。體細胞應該是在體內能保持相當長的壽命或者具有分裂能力的細胞,這樣才能使被轉入的基因能有效地、長期地發揮“治療”作用。因此幹細胞、前體細胞都是理想的轉基因治療靶細胞。以如今的觀點看,骨髓胞是唯一滿足以上標準的靶細胞,而骨髓的抽取,體外培養、再植入等所涉及的技術都已成熟;另一方面,骨髓細胞還構成了許多組織細胞(如單核巨噬細胞)的前體。因此,不僅一些涉及血液系統的疾病如ADA缺乏症、珠蛋白生成障礙性貧血、鐮狀細胞貧血、CGD等以骨髓細胞作為靶細胞,而且一些非血液系統疾病如苯丙酮尿症、溶酶體儲積病等也都以此作為靶細胞。除了骨髓以外,肝細胞、神經細胞、內皮細胞、肌細胞也可作為靶細胞來研究或實施轉基因治療。
(1)生殖細胞基因治療:生殖細胞基因治療(germ cell gene therapy)是將正常基因轉移到患者的生殖細胞(精細胞、卵細胞中早期胚胎)使其發育成正常個體,顯然,這是理想的方法。實際上,這種靶細胞的遺傳修飾至今尚無實質性進展。基因的這種轉移一般只能用顯微注射,然而效率不高,並且只適用排卵周期短而次數多的動物,這難適用於人類。而在人類實行基因轉移到生殖細胞,並世代遺傳,又涉及倫理學問題。因此,就人類而言,多不考慮生殖細胞的基因治療途徑。
(2)體細胞基因治療:體細胞基因治療(somatic cell gene therapy)是指將正常基因轉移到體細胞,使之表達基因產物,以達到治療目的。這種方法的理想措施是將外源正常基因導入靶體細胞內染色體特定基因座位,用健康的基因確切地替換異常的基因,使其發揮治療作用,同時還須減少隨機插入引起新的基因突變的可能性。對特定座位基因轉移,還有很大困難。
體細胞基因治療採用將基因轉移到基因組上非特定座位,即隨機整合。只要該基因能有效地表達出其產物,便可達到治療的目的。這不是修復基因結構異常而是補償異常基因的功能缺陷,這種策略易於獲得成功。基因治療中作為受體細胞的體細胞,多採取離體的體細胞,先在體外接受導入的外源基因,在有效表達後,再輸回到體內,這也就是間接基因治療法。
體細胞基因治療不必矯正所有的體細胞,因為每個體細胞都具有相同的染色體。有些基因只在一種類型的體細胞中表達,因此,治療只需集中到這類細胞上。其次,某些疾病,只需少量基因產物即可改善症狀,不需全部有關體細胞都充分表達。
概念
狹義概念
指用具有正常功能的基因置換或增補患者體內有缺陷的基因,因而達到治療疾病的目的。
廣義概念
![基因治療[醫學術語]](/img/d/1b7/wZwpmLwITM2EDM0ATO0ATN0UTMyITNykTO0EDMwAjMwUzLwkzLwUzLt92YucmbvRWdo5Cd0FmLxE2LvoDc0RHa.jpg) 基因治療[醫學術語]
基因治療[醫學術語]指把某些遺傳物質轉移到患者體內,使其在體內表達,最終達到治療某種疾病的方法。
主要分類
按基因操作
 基因治療
基因治療一類為基因修正(gene correction)和基因置換(gene replacement),即將缺陷基因的異常序列進行矯正,對缺陷基因精確地原位修復,不涉及基因組的其他任何改變。通過同源重組(homologous recombination)即基因打靶(gene targetting)技術將外源正常的基因在特定的部位進行重組,從而使缺陷基因在原位特異性修復。另一類為基因增強(gene augmentation)和基因失活(gene inactivation),是不去除異常基因,而通過導入外源基因使其表達正常產物,從而補償缺陷基因等的功能;或特異封閉某些基因的翻譯或轉錄,以達到抑制某些異常基因表達。
按靶細胞
又可分為生殖細胞(germ-line cell)基因治療和體細胞(somatic cell)基因治療。廣義的生殖細胞基因治療以精子,卵子和早期胚胎細胞作為治療對象。由於當前基因治療技術還不成熟,以及涉及一系列倫理學問題,生殖細胞基因治療仍屬禁區。在現有的條件下,基因治療僅限於體細胞。
給藥途徑
①ex vivo 途徑:這是指將含外源基因的載體在體外導入人體自身或異體細胞(或異種細胞),經體外細胞擴增後,輸回人體。ex vivo基因轉移途徑比較經典、安全,而且效果較易控制,但是步驟多、技術複雜、難度大,不容易推廣;
②in vivo 途徑:這是將外源基因裝配於特定的真核細胞表達載體,直接導入體內。這種載體可以是病毒型或非病毒性,甚至是裸DNA。in vivo基因轉移途徑操作簡便,容易推廣,但目前尚未成熟,存在療效持續時間短,免疫排斥及安全性等一系列問題。
策略
基因矯正
糾正致病基因中的異常鹼基,而正常部分予以保留。
基因置換
指用正常基因通過同源重組技術,原位替換致病基因,使細胞內的DNA 完全恢復正常狀態。
基因增補
把正常基因導入體細胞,通過基因的非定點整合使其表達,以補償缺陷基因的功能,或使原有基因的功能得到增強,但致病基因本身並未除去
基因失活
將特定的反義核酸(反義RNA、反義DNA)和核酶導入細胞,在轉錄和翻譯水平阻斷某些基因的異常表達,而實現治療的目的。
自殺基因
在某些病毒或細菌中的某基因可產生一種酶,它可將原無細胞毒或低毒藥物前體轉化為細胞毒物質,將細胞本身殺死,此種基因稱為“自殺基因”。
免疫治療
免疫基因治療是把產生抗病毒或腫瘤免疫力的對應與抗原決定簇基因導入機體細胞,以達到治療目的。如細胞因子(cytokine)基因的導入和表達等。
耐藥治療
耐藥基因治療是在腫瘤治療時,為提高機體耐受化療藥物的能力,把產生抗藥物毒性的基因導入人體細胞,以使機體耐受更大劑量的化療。如向骨髓幹細胞導入多藥抗性基因中的mdr-1。
基因治療
1.基因轉移方法
(1)特異正常基因的分離與克隆:套用重組DNA和分子克隆技術結合基因定位研究成果,已有不少基因並將會有更多人類基因被分離和克隆,這是基因治療的前提,在當代分子生物技術條件下,一般來說,只要有基因探針和準確的基因定位,任何基因都可被克隆。除此,如今既可人工合成DNA探針,還可用DNA合成儀在體外人工合成基因,這些都是在基因治療前,分離克隆特異基因的有利條件。
(2)外源基因的轉移:基因轉移(gene transfer)是將外源基因導入細胞內,其轉移方法較多,常用的要有下列幾類:
1)化學法:將正常基因DNA(及其拷貝)與帶電荷物質和磷酸鈣、DEAE-葡萄糖或與若干脂類混合,形成沉澱的DNA微細顆粒,直接傾入培養基中與細胞接觸,由於鈣離子有促進DNA透過細胞有作用,某些化合物可擾亂細胞膜,故可將DNA輸入細胞內,並整合於受體細胞的基因組中,在適當的條件下,整合基因得以表達,細胞亦可傳代。這種方法簡單,但效率極低,一般1000-100000個細胞中只有一個細胞可結合導入的外源基因。要達到治療目的,就需要從病人獲得大量所需的受體細胞。當然,可以通過選擇培養的方法來提高轉化率。
2)物理法:包括電穿孔法和直接顯微注射法。
①電穿孔法:電穿孔法(electroporotion)是將細胞置於高壓脈衝電場中,通過電擊使細胞產生可逆性的穿孔,周圍基質中的DNA可滲進細胞,但有時也會使細胞受到嚴重損傷。
②顯微注射法:顯微注射(microinjection)是在顯微鏡直視下,向細胞核內直接注射外源基因,這種方法應是有效的。但一次只能注射一個細胞,工作耗力費時。此法用於生殖細胞時,有效率可達10%。直接用於體細胞卻很困難。在動物實驗中,套用這種方法將目的基因注入生殖細胞,使之表達而傳代,這樣的動物就稱為轉基因動物,如今成功使用得較多的是轉基因小鼠(transgenic mice),它可作為繁殖大量後代的疾病動物模型。
③脂質體法:脂質體(liposome)法是套用人工脂質體包裝外源基因,再與靶細胞融合,或直接注入病灶組織,使之表達。
3)同源重組法:同源重組(homologous recombination)是將外源基因定位導入受體細胞的染色體上,在該座位因有同源序列,通過單一或雙交換,新基因片段替換有缺陷的片段,達到修正缺陷基因的目的。如在新基因片段旁組裝一Neo基因,則在同源重組後,因有Neo基因,可在含有新黴素(neomycin)的培養基中生長,從而使未插入新基因片段的細胞死亡。對於體細胞基因治療,體外培養細胞的時間不能過長,篩選量大,故在臨床上套用也受限制難以進行。今後如能改進技術,提高重組率,這種定點修正基因的方法仍是有前景的。
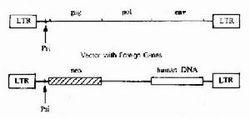
4)病毒介導基因轉移:前述的化學和物理方法都是通過傳染方式基因轉移。病毒介導基因轉移(viral mediatedgene transfer)是通過轉換方式完成基因轉移,即以病毒為載體(vector),將外源目的基因通過基因重組技術,將其組裝於病毒上,讓這種重組病毒去感染受體宿主細胞,這種病毒稱為病毒運載體(viral vector)。如今套用的有兩種病毒介導基因轉移方法。
①反轉錄病毒載體:反轉錄病毒雖是RNA病毒,但有反轉錄酶,可使RNA轉錄為DNA,再整合到宿主細胞基因組。反轉錄病毒載體有以下的優點首先是具有穿透細胞的能力,可使近100%的受體細胞被感染,轉化細胞效率高;其次,它能感染廣譜動物物種和細胞類型而無嚴格的組織特異性;再者隨機整俁的病毒可長期存留,一般無害於細胞,但也存在缺點:這種載體只能把其DNA整合到能旺盛分裂細胞的染色體,而不適合於那些不能正常分裂的細胞,如神經元。最嚴重的問題是由於病毒自身含有病毒蛋白及癌基因,就有使宿主細胞感染病毒和致癌的危險性。因此,人們有目的地將病毒基因及其癌基因除去,僅留它們的外殼蛋白,以保留其穿透細胞的功能,試圖避免上述缺點。這種改造後的病毒稱為缺陷型病毒(defective virus)。這樣的病毒中的反轉錄酶可將RNA轉化為DNA,有助於該DNA順利進入宿主細胞的基因組,而該病毒則死亡。由於病毒整合基因組是隨機的,所以還是可能激活細胞的原癌基因,以及因隨機插入發生插入突變。
在反轉錄病毒載體中,最常用於人類的是莫洛尼(Mooney)鼠白血病病毒(murine leukemia virus;Mo-MLV),其人工構建的結構。
②DNA病毒介導載體(DNA viral mekiated vector):DNA病毒包括腺病毒、SV40、牛乳頭瘤病毒、皰疹病毒等,一般認為這類病毒難於改造成缺陷型病毒。
牛乳頭瘤病毒重組後,可不插入宿主染色體中引起插入突變,又可在宿主染色體外獨立複製,並表達出基因產物。有人發現,因缺少E1區而致複製缺陷的腺病毒,可在表達E1基因的細胞中繁殖。後來證明,載有外源DNA的複製缺陷腺病毒呈現相同繁殖的特點。1993年美法等國成功採用腺病毒載體進行心、腦、肺、肝內膽管和肌肉組織的體內基因轉移。它代表了基因治療的新方向。
美國設計了一個新的腺病症載體,它是用一個化學連線器即賴氨酸鏈(lysine chain)將DNA栓在病毒外殼上,這樣組成的運輸器,通過一個表面抗體而進入細胞核,使宿主基因與治療基因共同表達。這個新病毒載體稱為腺病毒多賴氨酸DNA複合體(adeno virus-polylysine DNA-complex)。
採用複製缺陷的腺病毒進行基因治療有以下優點:
①該病毒可感染分裂和非分裂的細胞,並能得到大量基因產物,對神經細胞、心肌細胞等基因缺陷的糾正有特殊意義;
②病毒顆粒相對穩定,並易於純化和濃縮,且感染力不降低;
③可有效轉導多種靶細胞後而少游離於細胞基因組外,並持續表達;
④已用於基因治療的Ad5屬腺病毒C亞群,無致癌性。
前述的新腺病毒載體還有一大優點是可以成功地運載48000bp的基因,而其它病毒只能運輸70 00bp的基因。這些優點顯示了腺病毒介導載體的廣闊套用前景。
2.選擇靶細胞的原則
這裡所指的靶細胞是指接受轉移基因的體細胞。
選擇靶細胞的原則是:
①必須較堅固,足以耐受處理,並易於由人體分離又便於輸回體內;
②具有增殖優勢,生命周期長,能存活幾月至幾年,最後可延續至病人的整個生命期;
③易於受外源遺傳物質的轉化;
④在選用反轉錄病毒載體時,目的基因表達最好具有組織特異性的細胞。使用得較多的是骨髓幹細胞、皮膚成纖維細胞、肝細胞、血管內皮細胞和肌細胞等。許多遺傳病與造血細胞有關,故可用於如β地貧、嚴重複合免疫缺陷病等的基因治療。皮膚成纖維細胞易於移植和從體內分離,又可在培養中生長,並易存活,故有人用之於乙型血友病的基因治療。有不少遺傳病表現了肝細胞功能缺陷,因此,在家族性高膽固醇血症的治療中,有將低密度脂蛋白(LDL)受體基因轉移至肝細胞的嘗試。在動物實驗中已證明:β-半乳糖苷酶基因、ADA基因、小肌營養不良蛋白(minidystrophin)基因都已證明能在肌細胞中表達。
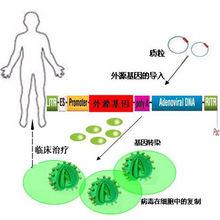
基本程式
 基因治療
基因治療(一)治療性基因的獲得
(二)基因載體的選擇
(三)靶細胞的選擇
(四)基因轉移方法
(五)轉導細胞的選擇鑑定
(六)回輸體內
基本步驟
轉移
 基因治療
基因治療在基因治療中迄今所套用的目的基因轉移方法可分為兩大類:病毒方法和非病毒方法。基因轉移的病毒方法中,RNA和DNA病毒都可用為基因轉移的載體。常用的有反轉錄病毒載體和腺病毒載體。轉移的基本過程是將目的基因重組到病毒基因組中,然後把重組病毒感染宿主細胞,以使目的基因能整合到宿主基因組內。非病毒方法有磷酸鈣沉澱法、脂質體轉染法、顯微注射法等。
表達
目的基因的表達是基因治療的關鍵之一。為此,可運用連鎖基因擴增等方法適當提高外源基因在細胞中的拷貝數。在重組病毒上連線啟動子或增強子等基因表達的控制信號,使整合在宿主基因組中的新基因高效表達,產生所需的某種蛋白質。
安全措施
為避免基因治療的風險,在套用於臨床之前,必須保證轉移-表達系統絕對安全,使新基因在宿主細胞表達後不危害細胞和人體自身,不引起癌基因的激活和抗癌基因的失活等,尤其是在將反轉錄載體用於基因轉移時,必須在套用到人體前預先在人骨髓細胞、小鼠體內和靈長類動物體內進行類似的研究,以確保治療的安全性。
現狀前景
腫瘤的基因治療
愛滋病的基因治療
遺傳病的基因治療
基因治療研究一般要符合下列要求
①為已明確了的單基因缺陷疾病;
②僅限於體細胞;
③靶細胞的親緣性和可操作性等;
④有明顯療效和無或低危害性等;
⑤表達水平穩定時程長;
⑥必須有動物實驗基礎。
人類細胞基因治療的臨床實驗已經開始。 進行基因治療必須具備下列條件:
①選擇適當的疾病,並對其發病機理及相應基因的結構功能了解清楚;
②糾正該病的基因已被克隆,並了解該基因表達與調控的機制與條件;
③該基因具有適宜的受體細胞並能在體外有效表達;
④具有安全有效的轉移載體和方法,以及可供利用的動物模型。
已對若干人類單基因遺傳病和腫瘤開展了臨床的基因治療。
1.複合免疫缺陷綜合徵的基因治療
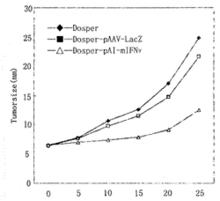
1991年美國批准了人類第一個對遺傳病進行體細胞基因治療的方案,即將腺苷脫氨酶(ADA)導入一個4歲患有嚴重複合免疫缺陷綜合徵(SCID)的女孩。採用的是反轉錄病毒介導的間接法,即用含有正常人腺苷脫氨酶基因的反轉錄病毒載體培養患兒的白細胞,並用白細胞介素Ⅱ(IL-2)刺激其增殖,經10天左右再經靜泳輸入患兒。大約1-2月治療一次,8個月後,患兒體內ADA水平達到正常值的25%,未見明顯副作用。此後又進行第2例治療獲得類似的效果。
2.黑色素瘤的基因治療對腫瘤進行基因治療
是人們早已期望的事,在進行了多方面探索的基礎上,發現了腫瘤浸潤淋巴細胞(tumorinfiltrating lymphocyte-TIL,即能在腫瘤部位持續存在而無副作用的一種淋巴細胞)在腫瘤治療中的作用。於1992年實施了TNF/腫瘤細胞和IL-2/腫瘤細胞方案,即分別將IL-2基因腫瘤壞死因子(tumor necrosis ractor,TNF)基因導入取自患者自身並經培養的腫瘤細胞,再將這些培養後的腫瘤細胞注射至病人臀部,3周后切除注射部位與其引流的淋巴結,在適合條件下培養T細胞,將擴增的T細胞與IL-2合併用於病人,結果5名黑色素瘤病人中1名腫瘤完全消退,2名90%的腫瘤消退,另2人在治療後9個月死亡。由於攜有TNF的TIL可積於腫瘤處,因而TIL的套用提高了對腫瘤的殺傷作用。
3.其它遺傳病的基因治療其它遺傳病
諸如白種人中常見的囊性纖維化的進展很快。對於DMD的基因治療,由於有小鼠動物模型,也取得一定進展。例如1993年法國將Ad-RSVmDys(腺病毒-羅斯病毒小肌營養不良蛋白基因重組體)注入小鼠肌內成功。即用腺病毒為載體,與小肌營養不良蛋白(minidystrophin)基因的cDNA重組,在RSV啟動子啟動下,作肌肉注射,證明可在mdy小鼠肌肉表達,此外,對一些遺傳病如血友病,地中海貧血、高雪氏病等正在探索中。
浙江大學孔德華博士等單位對乙型血友病的基因治療也進行了有意義的探索,他們在兔模型的基礎上,將人第Ⅸ因子基因通過重組質粒(pcmvix)或重組反轉錄病毒(N2CMVIX)導入自體皮膚成纖維細胞,獲得可喜的階段性成果,相信不久的將來,基因治療會在我國取得成功。
4.反義技術
又稱反義寡核苷酸(antisenseoligodeoxynucleotides)技術,是指利用人工合成的反義RNA和反義DNA來阻斷基因的轉錄或複製,控制細胞生長在中間階段,使編碼蛋白質的基因能轉錄為mRNA,因而不能翻譯成相應的蛋白質,以達治療某一疾病的目的、用反義DNA已對某些癌症進行臨床試驗。這類反義技術只能認為是一種從基因水平進行治療的技術,它們以不同方式,在DNA複製、轉錄和翻譯水平發揮作用。由於它們的分子量低,故而有潛力進入靶細胞,但其臨床穩定性、毒性、細胞通透性等各方面都需要進一步研究。
5.藥物靶向治療(drugstargeting)
此法機理可概括為病毒導向酶的藥物前體治療(virus directed enzyemeprodrug therapy,VDEPT),即用反轉錄病毒載體的外源基因轉移到細胞內。該基因編碼一種酶,此酶可將一種無害的藥物前體轉變為細胞毒素複合物。帶有這一基因的病毒載體只在特殊組織或腫瘤細胞中而不在正常細胞中表達。例如,胞嘧啶脫氨酶(cytosine deaminase)可將無害的5-氟胞嘧啶(5-fluorocytosine,5-FC)轉變為細胞毒素5-氟胞嘧啶(5-fluorocytosine,5-FC)。此病毒可感染正常細胞和癌細胞,但將該酶基因連線到一種“分子開關”後,則只能在腫瘤細胞中表達。Sikora等設計一個“嵌合小基因(chimeric minigene)”,即將酶基因連線到erbB2基因啟動子的下游,此啟動子活性增強,使erbB2在乳腺癌細胞中過度表達。此時,藥物5-FC注入細胞後即轉變為5-FU而致癌細胞死亡。而當5-FC給予含有此嵌合基因卻無erbB2表達的細胞時,亦無藥物前體活性。這一基因治療的新策略,可有可能使人對腫瘤等不同疾病進行基因治療。
已批准治療的病例約120例,其中約110例為腫瘤,遺憾的是,除黑色素瘤有些苗頭外,全都未能成功。治療了10餘例單基因病,除ADA缺乏症和乙型血友病有一定療效外,其餘都還在實驗階段。但人們再也不懷疑基因治療不僅可能辦到,而且指日可待。
在中國
1991年,我國科學家進行了世界上首例血友病B的基因治療臨床試驗,目已有4名血友病患者接受了基因治療,治療後體內IX因子濃度上升,出血症狀減輕,取得了安全有效的治療效果。隨後,我國科學家利用胸腺激酶基因治療惡性腦膠質瘤基因治療方案獲準進入1期臨床試驗,初步的觀察表明,生存期超過1年以上者占55%,其中 1例已超過三年半,至今仍未見腫瘤復發。此外,採用血管內皮生長因子基因治療外周梗塞性下肢血管病基因治療方案也已獲準進入臨床試驗。我國已有6個基因治療方案進入或即將進入臨床試驗。
總的來看,我國基因治療產業比美國落後了約4年,正處於成長階段,絕大部分還處於實驗室研究階段,僅有大約5個項目通過審批進入特批臨床試驗或I、Ⅱ期臨床試驗。
倫理學
1.導入基因的穩定高效表達外源基因轉移入病人體內細胞表達,
首先與轉移方法有關。化學和物理方法所導入的基因效率低,自然表達也差。選擇適當的受體細胞,也是為了導入基因能穩定高效的表達。骨髓作為受體細胞使用最多。反轉錄病毒載體介導基因,只能對分裂狀態時的細胞進行傳染,因此採取如5-FU處理,使細胞分裂增強,再用含有目的基因病毒顆粒傳染可獲較好效果。所以,對骨髓細胞培養、幹細胞純化、培養時使用造血因子等方法,可增加基因穩定高效表達。
2.導入基因的安全性基因治療的安全性應確保不因導入外源目的基因而產生新的有害遺傳變異,這是因為採用反轉錄病毒載體而引起的問題。因此,應構建相對安全的反轉錄病毒載體。至於引起插入突變可能失活一個重要基因,或更嚴重的激活一個原癌基因,這個問題的危險程度到底有多大仍不清楚,但至今的實踐表明尚未見明顯嚴重問題。
為安全有效地進行基因治療,任一方案的實施,都要根據嚴格的技術規程與標準,由有關的行政管理部門批准實施。
與安全性相聯繫的就是生殖細胞基因治療。雖然在人類尚未實施,但在動物實驗已獲成功,這就是轉基因的動物出現。這一事實既給人類生殖細胞基因治療帶來了希望,同時也使人們耽心這種遺傳特徵的變化世代相傳,將給人類帶來的是福還是禍。因此,許多科學家不僅對此持慎重態度,還有的持反對態度,也就是基因治療可能具有的潛在危險性。
3.基因治療與社會倫理道德體細胞基因治療是符合倫理道德的,但試圖糾正生殖細胞遺傳缺陷或通過遺傳工程手段來改變正常人的遺傳特徵則是引起爭議的領域。從歷史上看,科學的發明創造對人類生存發展的影響極其深刻,故遺傳學發展到今天,可以進行基因治療,應該說是符合倫理道德的。重要的問題是取得社會的理解配合。首先是病人及其親屬的配合。因此,宣傳基因治療的科學性與安全性以及人類健康的重要性,以提高人們的認識,同時建立並完善醫療法制與措施也是必要的。
為安全計,在臨床試驗之前,必須在動物研究中達到三項基本要求:①外源的基因能導入靶細胞並維持足夠長期有效;②該基因要以足夠的水平在細胞中表達;③該基因應對細胞無害。
基因治療的歷史沿革
(1)1962年Szybalski等人類DNA去轉化人類細胞,發現Ca2﹢有刺激DNA轉入細胞的作用,為人工轉移遺傳物質邁出第一步。
(2)1967年Nirenberg提出遺傳工程空用於人類基因治療。
(3)1968年Burnett等用DEAE協同轉移的方法將病毒導入培養細胞。
(4)1972年Grahant等對磷酸鈣介導的DNA轉移過程進行了詳細的研究,使這一技術得到普遍的接受和套用。
(5)70年代初Graessman和Dicumak奠定了用顯微注射法轉移基因。
(6)1973年美國科學家和幾名醫生在德國進行了首次基因治療實驗。病人是一對體內缺乏一種稀有酶的姐妹研究人員將一種攜帶有可使病人本身的酶分泌恢復正常的的病毒-肖普化乳頭瘤病毒注入患者體內。實驗無療效也無副作用。
(7)1980年美國醫生對兩名嚴重地中海貧血患者進行基因治療,但也未能獲得成功。
(8)1988年美國國家衛生研究院重組DNA諮詢委員會首次批准將標記基因導入腫瘤浸潤淋巴細胞的實施方案。其結果對病人無害作用。基因治療逐漸解禁。
(9)1990年9月研究人員把線桿脫氫酶基因轉入患者體內,其症狀明顯緩解,治療獲得成功。
(10)在1991年中國復旦大學的研究人員進行了“成纖維殘暴基因治療血友病B”項目,此外還開展了針對腫瘤和血液病的基因治療。
(11)2000年9月,一名18歲的男青年因基因治療而死於美國費城。美國《科學》雜誌曾連續刊登了美國食品和藥品管理局(FDA)宣布暫時禁止某大學進行基因治療試驗的報導。
(12)截至2005年7月,全世界已獲準的基因治療臨床實驗方案達1076項,其中,66%是針對癌症的治療。
經過十多年的發展,基因治療的研究已經取得了不少進展。但是,如今都還處於初期臨床試驗階段,還不能保證穩定的療效和安全性。儘管存在著許多障礙,但基因治療的發展趨勢仍是令人鼓舞的。或許正如基因治療的奠基者所欲言的那樣,基因治療這一新技術將會推動21世紀的醫學革命。
![基因治療[醫學術語] 基因治療[醫學術語]](/img/6/532/nBnauM3X0QDNykjMyUzM5EDN0UTMyITNykTO0EDMwAjMwUzL1MzL1czLt92YucmbvRWdo5Cd0FmLwE2LvoDc0RHa.jpg)
