基本原理
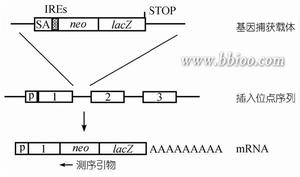 基因捕獲
基因捕獲主要分類
 基因捕獲
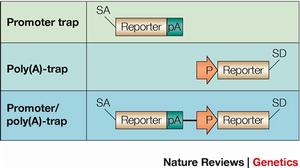
基因捕獲增強子捕獲載體含有一個最小的啟動子和翻譯起始位點,當載體整合到順式增強子元件附近時,此增強子將調控報告基因的表達。對報告基因在體內表達的ES細胞系插入位點進行克隆鑑定發現插入位置鄰近編碼序列。關於增強子捕獲的誘變比率還未見報導,但插入的性質預示由增強子捕獲產生功能失活的突變比率較低,因此,增強子捕獲載體在小鼠體系中未得到廣泛套用。
啟動子捕獲載體通常由不含啟動子成分的報告基因和一篩選標記基因組成,只有當載體插入到內源基因編碼區序列中產生融合轉錄本時報告基因才可能表達。因而啟動子捕獲的致突變比率很高。然而載體插入到外顯子的頻率非常低,捕獲效率較增強子捕獲至少低200倍。故載體中通常含有一個篩選標記基因,如新黴素抗性基因(neo)或β-半乳糖苷酶(galactosidase)與neo的融合基因(β-GEO),保證載體插入的細胞克隆被篩選保留。由於插入發生在DNA轉錄區,克隆插入位點就可確定突變基因。
基因捕獲載體中在無啟動子序列的報告基因上游和下游分別含有剪接受體(spliceacceptor,SA)和多聚腺苷酸加尾序列(polyA),當含有順式作用的啟動子和增強子元件被捕獲基因轉錄激活時,載體中SA與內源基因剪接供體(splicedonor,SD)作用產生上游內源基因編碼序列與報告基因融合轉錄本,使內源基因發生突變,同時報告基因的表達提示內源基因的表達特點。融合轉錄產物可作為克隆突變基因序列的模板。由於插入發生在內含子中,基因捕獲的效率較啟動子捕獲至少提高50倍。然而選擇性剪接(alternativesplicing)的發生會導致低水平的野生型轉錄本產生而形成減效等位基因突變。
設計及套用
 基因捕獲
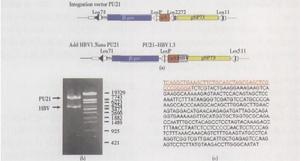
基因捕獲早期基因捕獲載體的特點是當報告基因與內源基因的讀碼框一致時,產生由內源蛋白的N末端與報告基因蛋白融合的活性蛋白質。近來對這一類載體所做的改進是在報告基因與SA序列間插入一來源於腦、心肌炎病毒的IRES,這樣即使報告基因與捕獲基因不發生融合也可產生報告基因翻譯產物。儘管ES細胞中大量基因具轉錄活性,為了獲得全基因組突變克隆必須使用不依賴於捕獲基因表達的篩選策略。因此,在第一、二代基因捕獲載體中套用報告基因和含自身啟動子(PGK)的篩選標記基因neo,抗藥性的產生不需要捕獲基因的表達。不同的是,第二代基因捕獲載體中篩選標記基因3′末端沒有polyA加尾信號而含有一剪接供體序列,必須由內源基因提供polyA加尾信號以產生穩定的篩選標記基因mRNA而獲得篩選克隆,因此與第一代載體相比,降低了基因間插入的背景。polyA捕獲載體還解決了第一代基因捕獲載體突變基因信息鑑定的難題。3′-RACE可用以鑑定polyA捕獲基因3′端編碼序列或3′非翻譯區(UTRs)序列信息,對於基因鑑定比5′-UTRs序列有用得多。用以克隆捕獲特異類型蛋白編碼基因的多種新型載體也已問世,如Skarnes等利用分泌蛋白的原理及β-gal活性在內質網被滅活的特點設計了一種載體專門用以捕獲在ES細胞中表達的編碼穿膜分泌蛋白的基因。一些研究小組還在載體中引入了重組位點,以實現由重組酶介導的捕獲位點插入後修飾。這種“敲進”的策略允許對捕獲位點作進一步修飾,如“指派”捕獲基因的啟動子成分驅動敲入的轉基因表達來進行“回復突變(rescue)”或細胞標記實驗;通過敲入含不同突變的捕獲基因cDNA還可產生等位基因系列;含lox位點的載體還可實現在捕獲基因組條件性取代載體產生更精細的突變,包括點突變和/或選擇性表型標記,可以更好地控制突變的性質。
基因捕獲實驗
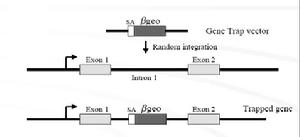 基因捕獲
基因捕獲利用基因捕獲可以建立一個攜帶隨機插入突變的ES細胞庫,節省大量篩選染色體組文庫以及構建特異打靶載體的工作及費用,更有效和更迅速地進行小鼠染色體組的功能分析。基因捕獲的策略如圖3所示.典型的基因捕獲載體包括一個無啟動子的報導基因,通常是neo基因。neo基因插入到ES細胞染色體組中,並利用捕獲基因的轉錄調控元件實現表達的ES克隆可以很容易地在含G418的選擇培養基中篩選出來。
從理論上講,在選擇培養基中存活的克隆應該100%地含有中靶基因。中靶基因的信息可以通過篩選標記基因側翼cDNA或染色體組序列分析來獲得。用基因捕獲法在單次實驗中可以獲得數以百計的帶有單基因剔除的ES克隆。這些克隆可以在96孔培養板中生長複製並用於基因型分析。大規模地保存和分析中靶ES細胞在小型的實驗室中也是可行的.此方法的缺點是只能剔除在ES細胞中表達的基因。單種的細胞類型中表達的基因數目約為104。
現在的基因捕獲載體從理論上來講應能剔除所有在ES細胞表達的基因,因此,在ES細胞中進行基因捕獲還是大有可為的。1997年後,克隆技術接連取得重要突破,用哺乳動物體細胞可以克隆出新個體。可以構想在體細胞中套用基因捕獲可以剔除更多在發育晚期才表達的基因,其後通過核移植技術獲得帶有突變基因的動物個體,這不失為一種可以彌補以上缺陷的辦法。用基因捕獲法進行基因剔除的另一個缺點是無法對基因進行精細的遺傳修飾。