一、藥品的取用和存放
1.藥品取用的原則①不能用手接觸藥品,不要把鼻孔湊到容器口去聞藥品(特別是氣體)的氣味,不得嘗任何藥品的味道。②注意節約藥品。應該嚴格按照實驗規定的用量取用藥品。如果沒有說明用量,一般應該按最少量取用:液體1~2毫升,固體只需蓋滿試管底部。③實驗剩餘的藥品既不能放回原瓶,也不要隨意丟棄,更不要拿出實驗室,要放入指定的容器內。(Na、K放回原瓶)
2.藥品取用的方法(1)固體藥品的取用:藥匙、鑷子或紙槽;一橫二送三慢立
(2)液體藥品的取用:用膠頭滴管等器具或用傾倒法。傾倒法:瓶塞倒放在桌上,標籤對著手心,瓶口要緊挨著試管口,試管傾斜,使液體緩緩地倒入試管。倒完液體,立即蓋緊瓶塞,把瓶子放回原處。
(3)特殊藥品的取用
鈉和鉀等活潑金屬:用鑷子取出,用濾紙吸乾煤油,餘下的放回原瓶;白磷:用鑷子夾持住白磷,用小刀在水下切割。
| 常見試劑 | 特 性 | 保存方法 |
| 鹽酸、氨水、乙醛、苯、液溴 | 易揮發的試劑 | 密封、陰涼處。液溴水封 |
| 硝酸、H2O2、氯(溴)水、硝酸銀溶液 | 見光或受熱易分解 | 棕色瓶,陰涼、避光 |
| 硝酸、濃硫酸、溴水、KMnO4、汽油等 | 強氧化性;有機溶劑 | 用玻璃塞 |
| NaOH、Na2CO3 等 | 強鹼性 | 用橡皮塞 |
| FeSO4、Fe2(SO4)3 | 易水解 | 加酸,一般現配 |
| FeSO4、Na2SO3 、苯酚等 | 易被O2氧化 | 密封保存;FeSO4中加鐵粉 |
| NaOH | 和CO2、H2O、SiO2反應 | 用橡皮塞、密封保存 |
| Na、K | 和H2O、O2反應 | 保存在煤油中 |
| 白磷 | 易自燃 | 保存在水中 |
| Na2O2、漂白粉 | 和CO2反應 | 密封保存 |
| 氫氟酸 | 腐蝕玻璃 | 保存在塑膠瓶中 |
| 註:固體放在廣口瓶中,液體放在細口瓶中。 |
二、儀器的洗滌和試紙的使用
1.洗淨的標誌儀器內壁均勻附著水膜,既不聚成水滴,也不成股流下。
2.洗滌的方法酸洗法、鹼洗法、有機溶劑洗滌法、加熱灼燒法等
3.常見污跡的處理(1)檢驗溶液:將試紙放在表面皿或玻璃片上,用玻璃棒蘸取溶液點在試紙中部,觀察;(2)檢驗氣體:用蒸餾水將試紙潤濕,將其插入瓶內或放在瓶口觀察;(3)pH試紙使用前不能潤濕。
三、連線儀器裝置以及檢查裝置的氣密性
1.實驗儀器的連線和組裝玻璃管插入塞孔玻璃管套上橡皮管用橡皮塞塞住試管橡皮管、塞子、玻璃導管等的連線,關鍵掌握兩個字——潤、轉。①把玻璃管插入帶孔橡皮塞:左手拿橡皮塞,右手拿玻璃管,先把要插入塞子的玻璃管一端用水潤濕,然後稍稍用力轉動,使它插入。②連線玻璃管和橡皮管:左手拿橡皮管,右手拿玻璃管,先把玻璃管用水潤濕,然後稍稍用力即可插入。③在容器口塞橡皮塞:左手拿容器,右手拿橡皮塞慢慢轉動,塞進容器口。切不可把容器放在桌子上再使勁塞進塞子。
組裝整套儀器時應遵循先下後上,從左到右的原則。一般吸收裝置、洗氣裝置應長進短出,量氣裝置應短進長出,乾燥管應大進小出。拆卸裝置與組裝程式相反。拆卸加熱裝置、並有導管伸入到液體中時,應先將導管取出液面,再停止加熱,以防倒吸。
(1)原理:壓強原理 ①給裝置內的空氣預設一條通路並將其通入水中,使裝置內密封的空氣的壓強增大,體積膨脹,空氣就會沿著預設的通路逸出;②向裝置內注入液體達到一定的高度,將原先裝置內的空氣密封在內,由於液體高度的原因而增壓,若氣密性良好,液體就不會下降。
(2)方法:
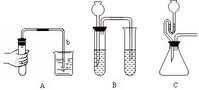 微熱法檢查裝置氣密性
微熱法檢查裝置氣密性②液差法 啟普發生器A:先關閉導管,向球形漏斗中加水,使漏斗中的
 液差法檢查裝置氣密性
液差法檢查裝置氣密性對於E裝置也可用以下方法檢查氣密性:關閉止水夾,將乾燥管插入水中,片刻後如果燒杯中的液面高於管內液面,則氣密性良好。
四、物質的溶解、過濾、蒸發和結晶
1.溶解(1)固體物質的溶解:用玻璃棒攪拌,可適當加熱;(2)液體的稀釋:一般將密度較大的液體加到密度較小的液體中,例如濃硫酸的稀釋是將濃硫酸沿著燒杯內壁緩緩注入水中,並不斷攪拌;(3)氣體的溶解:注意防止倒吸。
2.過濾過濾是一種分離固體和液體混合物的方法。一貼:濾紙緊貼漏斗內壁;二低:濾紙邊緣低於漏斗邊緣,漏斗中液體的液面低於濾紙邊緣;三靠:傾倒液體的燒杯口緊靠玻璃棒,玻璃棒的末端緊靠三層濾紙一側,漏斗下端緊靠燒杯內壁。
3.蒸發蒸發是用加熱使液體揮發的方法減少溶液中的溶劑,使溶質從溶液中析出的方法。在加熱過程中,要用玻璃棒不斷攪拌,以免液體局部溫度過高而造成液滴飛濺;當蒸發皿中出現較多量固體時停止加熱,利用餘熱使濾液蒸乾。注意:蒸發皿應放在石棉網上冷卻。
4.結晶結晶是使固體物質從溶液中以晶體狀態析出的過程,是提純、分離物質的方法之一。有兩種措施:一是蒸發溶劑,適用於溶解度隨溫度變化不大的物質,如NaCl、KCl;二是冷卻熱飽和溶液,適用於溶解度隨溫度變化大的物質,如KNO3、NaNO3。
五、物質的加熱
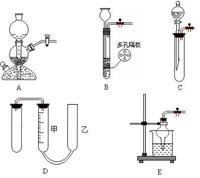
1、給試管中的固體加熱要用試管夾夾住離試管口1/3處,試管口略向下傾斜,先均勻受熱再定點加熱;
2、給試管里的液體加熱也要進行預熱,液體體積最好不要超過試管容積的1/3,試管口向上傾斜(約45°角)。加熱時切不可讓試管口朝著自己和有人的方向。
3、水浴加熱用於要求受熱均勻且溫度不超過100℃的加熱,優點是受熱均勻,易於控制反應溫度。
六、蒸餾、分液、萃取和升華
1.蒸餾蒸餾是提純或分離幾種互溶且沸點不同的液體混合物的方法。①蒸餾燒瓶中加碎瓷片,以防止暴沸;②溫度計水銀球與支管口在同一水平線上;③冷卻水低進高出。
2.分液分液是將兩種互不相溶的液體分離的操作。①用前查漏;②放液時要打開上蓋,下層液體由下口放出,上層液體由上口倒出。
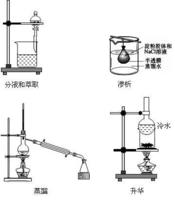
萃取是利用溶質在互不相溶的溶劑里溶解度的不同,用一種溶劑把溶質從另一種溶劑中提取出來的方法,和分液結合進行。條件是①兩種溶劑互不相溶,不反應;②溶質在一種溶劑中的溶解度比在另一種溶劑中大。
4.升華利用某些物質具有升華的特性,將此物質和其他受熱不升華的物質分離的方法。
七、滲析和鹽析
1.滲析:利用半透膜,使膠體和混在其中的分子、離子分離的方法,用來提純、精製膠體。多次更換蒸餾水以提高滲析效果。
2.鹽析:利用某些物質在加入某些無機鹽時,其溶解度降低而凝聚來分離物質。製取肥皂時加入食鹽。提純蛋白質時加入可溶性濃的輕金屬無機鹽溶液。
