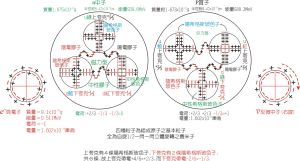
微粒半徑的規律
(1)除第1周期外,其他周期元素(惰性氣體元素除外)的原子半徑隨原子序數的遞增而減小;
(2)同主族元素,從上到下,原子半徑及同價態的離子半徑依次增大。如:F<Cl
(3)同一元素不同價態的粒子低價態的半徑大,如Fe2+>Fe3+。
(4)對於電子層結構相同的離子,核電荷數多的半徑小,核電荷數少的半徑大,如:S2->Cl->K+>Ca2+(5) 同一周期的離子半徑,陰離子大於陽離子,如S2->Cl->Na+>Mg2+>Al3+。
規律總結: 在中學化學要求的範疇可按“三看”來比較微粒半徑的大小:
“一看”電子層數:當電子層數不同時,同類元素(金屬或非金屬元素)電子層數越多,半徑越大。
“二看”核電荷數:當電子層數相同時,核電荷數越多,半徑越小。
“三看”核外電子數:當電子層數和核電荷數均相同時,核外電子數越多半徑越大元素化合價(以下規律只符合主族元素,不符合過渡族元素) (1)除第1周期外,同周期從左到右,元素最高正價由鹼金屬+1遞增到+7(氟無正價,氧無+6價,除外,非金屬元素負價由碳族-4遞增到-1;
(2)同一主族的元素的最高正價、負價均相同
單質的熔點
(1)同一周期元素隨原子序數的遞增,元素組成的金屬單質的熔點遞增,非金屬單質的熔點遞減;
(2)同一族元素從上到下,元素組成的金屬單質的熔點遞減,非金屬單質的熔點遞增
非金屬性
元素的金屬性與非金屬性
(1)同一周期的元素從左到右金屬性遞減,非金屬性遞增;
(2)同一主族元素從上到下金屬性遞增,非金屬性遞減。
最高價的酸鹼性
最高價氧化物和水化物的酸鹼性
元素的金屬性越強,其最高價氧化物的水化物的鹼性越強;元素的非金屬性越強,最高價氧化物的水化物的酸性越強。
非金屬氣態氫化物
元素非金屬性越強,氣態氫化物越穩定。同周期非金屬元素的非金屬性越強,其氣態氫化物水溶液一般酸性越強;同主族非金屬元素的非金屬性越強,其氣態氫化物水溶液的酸性越弱。
單質的氧化性、還原性
一般元素的金屬性越強,其單質的還原性越強,其氧化物的氧離子氧化性越弱;元素的非金屬性越強,其單質的氧化性越強,其簡單陰離子的還原性越弱。
推斷元素位置的規律
判斷元素在周期表中位置應牢記的規律:
(1)元素周期數等於核外電子層數;
(2)主族元素的序數等於最外層電子數