計算方法
首先需要說明,電負性是相對值,所以沒有單位。而且電負性的計算方法有多種(即採用不同的標度),因而每一種方法的電負性數值都不同,所以利用電負性值時,必須是同一套數值進行比較。比較有代表性的電負性計算方法有3種:
① 1932年L.C.鮑林提出的標度。根據熱化學數據和分子的鍵能,指定氟的電負性為4.0(後人改為3.98),計算其他元素的相對電負性(稀有氣體未計)。
鮑林的計算方法是:
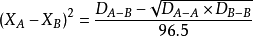 電負性
電負性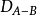 電負性
電負性其中
,
,
分別指A2,AB,B2分子的鍵能
②1934年R.S.密立根從電離勢和電子親合能計算的絕對電負性,即電離能和電子親和能的平均值。
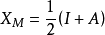 電負性
電負性I為電離能,A為電子親和能(放熱為正,吸熱為負)
③1956年A.L.阿萊和E.羅周提出的建立在核和成鍵原子的電子靜電作用基礎上的電負性。
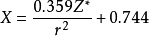 電負性
電負性即
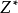 電負性
電負性其中
為有效核電荷數,r為半徑
④1989年L.C.Allen根據光譜實驗數據以基態自由原子價層電子的平均單位電子能量為基礎獲得主族元素的電負性:
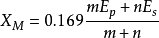 電負性
電負性m和n分別為p軌道和s軌道上的電子數,Ep和Es分別為s軌道和p軌道的電子平均能量。
常見變化
非金屬系:氟>氧>氯>氮>溴> 碘>硫>碳
金屬系:鋁>鈹>鎂>鈣>鋰>鈉>鉀
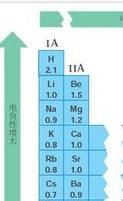
周期變化
氫 2.1 鋰1.0 鈹 1.57 硼 2.04 碳 2.55 氮 3.04 氧 3.44 氟 3.98
鈉 0.93 鎂 1.31 鋁 1.61 矽 1.90 磷 2.19 硫 2.58 氯 3.16
鉀 0.82 鈣 1.00 錳 1.55 鐵 1.83 鎳 1.91 銅 1.9 鋅 1.65 鎵 1.81 鍺 2.01 砷 2.18 硒 2.48 溴 2.96
銣 0.82 鍶 0.95 銀 1.93 碘 2.66 鋇 0.89 金 2.54 鉛 2.33
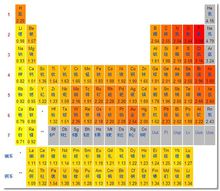 所有元素精確電負性
所有元素精確電負性一般來說,周期表從左到右,元素的電負性逐漸變大;周期表從上到下,元素的電負性逐漸變小。
電負性也可以作為判斷元素的金屬性和非金屬性強弱的尺度。一般來說,電負性大於1.8的是非金屬元素,小於1.8的是金屬元素,而位於非金屬三角區邊界的“類金屬”(如鍺、銻等)的電負性則在1.8左右,它們既有金屬性又有非金屬性。
遞變規律
 鮑林研究電負性的手稿
鮑林研究電負性的手稿1.隨著原子序號的遞增,元素的電負性呈現
周期性變化。
2.同一周期,從左到右元素電負性遞增,同一主族,自上而下元素電負性遞減。對副族而言,同族元素的電負性也大體呈現這種變化趨勢。因此,電負性大的元素集中在元素周期表的右上角,電負性小的元素集中在左下角。
3.非金屬元素的電負性越大,非金屬元素越活潑,金屬元素的電負性越小,金屬元素越活潑。氟的電負性最大(4.0),是最活潑的非金屬元素;鍅是電負性最小的元素(0.7),是最活潑的金屬元素。
4.過渡元素的電負性值無明顯規律。
套用
(1)判斷元素的金屬性和非金屬性。一般認為,電負性大於1.8的是非金屬元素,小於1.8的是金屬元素,在1.8左右的元素既有金屬性又有非金屬性。
(2)判斷化合物中元素化合價的正負。電負性數值小的元素在化合物吸引電子的能力弱,元素的化合價為正值;電負性大的元素在化合物中吸引電子的能力強,元素的化合價為負值。
(3)判斷分子的極性和鍵型。電負性相同的非金屬元素化合形成化合物時,形成非極性共價鍵,其分子都是非極性分子;通常認為,電負性差值小於1.7的兩種元素的原子之間形成極性共價鍵,相應的化合物是共價化合物;電負性差值大於1.7的兩種元素化合時,形成離子鍵,相應的化合物為離子化合物。
(4)元素周期表中的“對角線規則”。元素周期表中某些主族元素與右下方的主族元素電負性相近,性質相似。