發展歷程
 電池
電池在古代,人類有可能已經不斷地在研究和測試“電”這種東西了。一個被認為有數千年歷史的粘土瓶在1932年於伊拉克的巴格達附近被發現。它有一根插在銅製圓筒里的鐵條-可能是用來儲存靜電用的,然而瓶子的秘密可能永遠無法被揭曉。不管制造這個粘土瓶的祖先是否知道有關靜電的事情,但可以確定的是古希臘人絕對知道。他們曉得如果摩擦一塊琥珀,就能吸引輕的物體。
在十八世紀的四五十年代,發電裝置的改善和大氣電現象的研究,吸引了物理學家們的廣泛興趣,1745年,普魯士的克萊斯特利用導線將摩擦所起的電引向裝有鐵釘的玻璃瓶。當他用手觸及鐵釘時,受到猛烈的一擊。可能是在這個發現的啟發下,萊頓大學的馬森布羅克在1746年發明了收集電荷的“萊頓瓶”。因為他看到好不容易收集的電卻很容易地在空氣中逐漸消失,他想尋找一種保存電的方法。有一天,他用一支槍管懸在空中,用起電機與槍管連著,另用一根銅線從槍管中引出,浸入一個盛有水的玻璃瓶中,他讓一個助手一隻手握著玻璃瓶,馬森布羅克在一旁使勁搖動起電機。這時他的助手不小心將中另一隻手與槍管碰上,他猛然感到一次強烈的電擊,喊了起來。馬森布羅克於是與助手互換了一下,讓助手搖起電機,他自己一手拿水瓶子,另一隻手去碰槍管。
1780年,義大利解剖學家伽伐尼(LuigiGalvani)在做青蛙解剖時,兩手分別拿著不同的金屬器械,無意中同時碰在青蛙的大腿上,青蛙腿部的肌肉立刻抽搐了一下,仿佛受到電流的刺激,而如果只用一種金屬器械去觸動青蛙,就無此種反應。伽伐尼認為,出現這種現像是因為動物軀體內部產生的一種電,他稱之為“生物電”。伽伐尼的發現引起了物理學家們極大興趣的,他們競相重複枷伐尼的實驗,企圖找到一種產生電流的方法,義大利物理學家伏特在多次實驗後認為:伽伐尼的“生物電”之說並不正確,青蛙的肌肉之所以起作用。為了論證自己的觀點,伏特把兩種不同的金屬片浸在各種溶液中進行試驗。結果發現,這兩種金屬片中,只要有一種與溶液發生了化學反應,金屬片之間就能夠產生電流。1799年,伏特把一塊鋅板和一塊錫板浸在鹽水裡,發現連線兩塊金屬的導線中有電流通過。於是,他就把許多鋅片與銀片之間墊上浸透鹽水的絨布或紙片,平疊起來。用手觸摸兩端時,會感到強烈的電流刺激。伏特用這種方法成功地製成了世界上第一個電池──“伏特電堆”。這個“伏特電堆”實際上就是串聯的電池組。它成為早期電學實驗,電報機的電力來源。
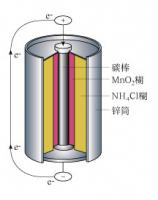
1836年,英國的丹尼爾對“伏特電堆”進行了改良。他使用稀硫酸作電解液,解決了電池極化問題,製造出第一個不極化,能保持平衡電流的鋅─銅電池此後,這些電池都在電壓隨著使用時間延長而下降的問題。當電池使用一段時間後電壓下降時,電池電壓回升。因為這種電池能充電,可以反覆使用,所以稱它為“蓄電池”。然而,無論哪種電池都需在兩個金屬板之間灌裝液體,因此搬運很不方便,特別是蓄電池所用液體是硫酸,在挪動時很危險。也是在1860年,法國的雷克蘭士(GeorgeLeclanche)還發明了世界廣受使用的電池(碳鋅電池)的前身。它的負極是鋅和汞的合金棒(鋅-伏特原型電池的負極,經證明是作為負極製作材料的最佳金屬之一),而它的正極是以一個多孔的杯子盛裝著碾碎的二氧化錳和碳的混合物。在此混合物中插有一根碳棒作為電流收集器。負極棒和正極杯都被浸在作為電解液的氯化銨溶液中。此系統被稱為“濕電池”。雷克蘭士製造的電池雖然簡陋但卻便宜,所以一直到1880年才被改進的“乾電池”取代。負極被改進成鋅罐(即電池的外殼),電解液變為糊狀而非液體,基本上這就是現在我們所熟知的碳鋅電池。
1887年,英國人赫勒森發明了最早的乾電池。乾電池的電解液為糊狀,不會溢漏,便於攜帶,因此獲得了廣泛套用。1890年,愛迪生(ThomasEdison)發明可充電鐵鎳電池。
工作原理
 電子-模型圖
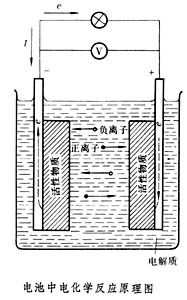
電子-模型圖 電池使用過程電池放電過程,電池放電時在負極上進行氧化反應,向外提供電子,在正極上進行還原反應,從外電路接受電子,電流經外電路而從正極流向負極,電解質是離子導體,離子在電池內部的正負極之間的定向移動而導電,陽離子流向正極,陰離子流向負極。電池放電的負極為陽極,放電的正極為陰極,在陽極兩類導體界面上發生氧化反應,在陰極的兩類導體界面上發生還原反應。整個電池形成了一個由外電路的電子體系和電解質液的離子體系構成的完整放電體系,從而產生電能供電。
 電池
電池在化學電池中,化學能直接轉變為電能是靠電池內部自發進行氧化、還原等化學反應的結果,這種反應分別在兩個電極上進行(見圖)。負極活性物質由電位較負並在電解質中穩定的還原劑組成,如鋅、鎘、鉛等活潑金屬和氫或碳氫化合物等。正極活性物質由電位較正並在電解質中穩定的氧化劑組成,如二氧化錳、二氧化鉛、氧化鎳等金屬氧化物,氧或空氣,鹵素及其鹽類,含氧酸及其鹽類等。電解質則是具有良好離子導電性的材料,如酸、鹼、鹽的水溶液,有機或無機非水溶液、熔融鹽或固體電解質等。當外電路斷開時,兩極之間雖然有電位差(開路電壓),但沒有電流,存儲在電池中的化學能並不轉換為電能。當外電路閉合時,在兩電極電位差的作用下即有電流流過外電路。
同時在電池內部,由於電解質中不存在自由電子,電荷的傳遞必然伴隨兩極活性物質與電解質界面的氧化或還原反應,以及反應物和反應產物的物質遷移。電荷在電解質中的傳遞也要由離子的遷移來完成。因此,電池內部正常的電荷傳遞和物質傳遞過程是保證正常輸出電能的必要條件。充電時,電池內部的傳電和傳質過程的方向恰與放電相反;電極反應必須是可逆的,才能保證反方向傳質與傳電過程的正常進行。因此,電極反應可逆是構成蓄電池的必要條件。按照熱力學原理,在等溫等壓下,電池體系所能輸出的最大功即體系的自由能增量為
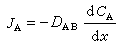
式中E為電池電動勢(伏);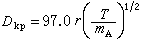 為吉布斯反應自由能增量(焦);F為法拉第常數=96500庫=26.8安·小時;n為電池反應的當量數。這是電池電動勢與電池反應之間的基本熱力學關係式,也是計算電池能量轉換效率的基本熱力學方程式。實際上,當電流流過電極時,電極電勢都要偏離熱力學平衡的電極電勢,這種現象稱為極化。電流密度(單位電極面積上通過的電流)越大,極化越嚴重。極化現象是造成電池能量損失的重要原因之一。極化的原因有三:①由電池中各部分電阻造成的極化稱為歐姆極化;②由電極-電解質界面層中電荷傳遞過程的阻滯造成的極化稱為活化極化;③由電極-電解質界面層中傳質過程遲緩而造成的極化稱為濃差極化。減小極化的方法是增大電極反應面積、減小電流密度、提高反應溫度以及改善電極表面的催化活性。
為吉布斯反應自由能增量(焦);F為法拉第常數=96500庫=26.8安·小時;n為電池反應的當量數。這是電池電動勢與電池反應之間的基本熱力學關係式,也是計算電池能量轉換效率的基本熱力學方程式。實際上,當電流流過電極時,電極電勢都要偏離熱力學平衡的電極電勢,這種現象稱為極化。電流密度(單位電極面積上通過的電流)越大,極化越嚴重。極化現象是造成電池能量損失的重要原因之一。極化的原因有三:①由電池中各部分電阻造成的極化稱為歐姆極化;②由電極-電解質界面層中電荷傳遞過程的阻滯造成的極化稱為活化極化;③由電極-電解質界面層中傳質過程遲緩而造成的極化稱為濃差極化。減小極化的方法是增大電極反應面積、減小電流密度、提高反應溫度以及改善電極表面的催化活性。
常用標準
IEC標準即國際電工委員會(International Electrical Commission),是由各國電工委員會組成的世界性標準化組織,其目的是為了促進世界電工電子領域的標準化。其中關於鎳鎘電池的標準為IEC285,關於鎳氫電池的標準是IEC61436,鋰離子電池目前IEC標準,一般電池行業依據的是SANYO或Panasonic的標準。
電池常用IEC標準有鎳鎘電池的標準為IEC602851999;鎳氫電池的標準為IEC614361998.1;鋰電池的標準為IEC619602000.11。
電池常用國家標準有鎳鎘電池的標準為GB/T11013_1996GB/T18289_2000;鎳氫電池的標準為GB/T15100_1994GB/T18288_2000;鋰電池的標準為GB/T10077_1998YD/T998_1999,GB/T18287_2000。
另外電池常用標準也有日本工業標準JIS C關於電池的標準及SANYOPANASONIC公司制定的關於電池企業標準。
特點
 電池
電池②工作時無噪聲,攜帶方便;
③由單體電池組成,可根據需要選用和組合。
按照能量轉換的方式,電池可分為:
1、利用電化學反應將化學能直接轉換成電能的化學電池,這類電池種類很多,套用很廣,統稱化學電源;
2、利用光伏效應將太陽光能直接轉換成電能的太陽電池;
3、利用塞貝克效應將熱能直接轉換成電能的溫差發電器;
4、將原子核放射能直接轉換為電能的核電池等。後三者都是利用物理效應,故又總稱物理電源。
電池技術
電池技術經過了長達數十年的發展。最初使用的是鉛酸電池,這種體積巨大的電池至今仍在汽車上廣泛使用。之後便是鎳鎘電池,這種充電電池開啟了便攜技術的新時代。然後就輪到了鎳氫電池,它的容量擴大了一倍。現代化的電子設備和電動汽車都採用了鋰電池。未來的電池技術將會採用更加複雜的名稱,例如鋰鈷鎳錳氧化物電池。這些材料的屬性非常複雜,而目前的工作不僅是要搞清楚這些材料為什麼能起效,還要搞清楚它們起效的方式——電子在材料中移動時遵循的基本物理原理。目前最受關注的就是鋰氧電池和鋰硫電池。如果能夠成功,鋰氧電池將比目前的鋰電池實現一個數量級的跨越。發展簡史
1600年Gilbert(美國)建立對電池的研究基礎。
1791年Gavani(義大利)提出“動物電”學說。
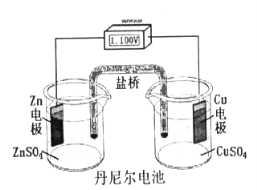 丹尼爾電池
丹尼爾電池1831年Farate(英國)宣布法拉第定律。
1836年Danide(英國)發明丹尼爾電池。
1840年Armstrong(英國)發明水力發電機。
1842年W.R.grove創製了氫-氧燃料電池。
1859年Plante(英國)發明鉛酸電池,1870年採用西門子發電機將鉛酸電池改為二次電池。
1866年Siemen(德國)對發電機進行改革。
1868年Leclanche(法國)研製成功Zn-MnO2電池並於1876年用樹脂作粘結劑改進原電池。
1888年Gassner(美國)發明糊式勒克謝電池,其結構形式沿用至今。
1889年Jungner(瑞典)二次Zn-Ag電池。
1898年Jungner(瑞典)發明Ni-Cd鹼性蓄電池。
1900年Jungner(瑞典)鹼性Zn-MnO2電池研製成功。
1901年Jungner(瑞典)與Edison(美國)合作發明Fe-Ni鹼性蓄電池。
1901年Michaelowski(俄羅斯)發明Zn-Ni電池。
 鋰離子電池
鋰離子電池1932年Ackermann(德國)發明了燒結式電極板。
1939年至1941年前蘇聯科學院院士A•H•ФPYMKUH研製成第一隻實用型“氫-氧燃料電池”。
1947年Neumann(法國)成功研製成密封式Ni-Cd電池。
1950年前蘇聯、法、德燒結式開口Ni-Cd電池開始生產、鹼性MnO2電池商品化。
1960年代美、前蘇聯研製成氫-鎳電池。
1970年代(美國)Li-SOCL2、Li-SO2在美國軍事及宇宙飛船上套用。
1984年(荷蘭)飛立浦公司解決了LaNi5合金在充放電過程中的容量衰減問題,拉開了MH-Ni電池開發熱潮。
1990年(日本)日本索尼公司宣布製成了鋰離子蓄電池並於1992年商品化。
1994年(美國)美國Bellcore公司宣布研製成功聚合物鋰離子電池。
電池分類
 乾電池
乾電池燃料電池是一種將燃料的化學能透過電化學反應直接轉化成電能的裝置燃料電池是利用氫氣在陽極進行的是氧化反應,將氫氣氧化成氫離子,而氧氣在陰極進行還原反應,與由陽極傳來的氫離子結合生成水。氧化還原反應過程中就可以產生電流。燃料電池的技術包括了出現鹼性燃料電池(AFC)、磷酸燃料電池(PAFC)、質子交換膜燃料電池(PEMFC)、熔融碳酸鹽燃料電池(MCFC)、固態氧化物燃料電池(SOFC),以及直接甲醇燃料電池(DMFC)等,而其中,利用甲醇氧化反應作為正極反應的燃料電池技術,更是被業界所看好而積極發展。
乾電池
常用的一種是碳-鋅乾電池。負極是鋅做的圓筒,內有氯化銨作為電解質,少量氯化鋅、惰性填料及水調成的糊狀電解質,正極是四周裹以摻有二氧化錳的糊狀電解質的一根碳棒。電極反應是:負極處鋅原子成為鋅離子(Zn++),釋出電子,正極處銨離子(NH4+)得到電子而成為氨氣與氫氣。用二氧化錳驅除氫氣以消除極化。電動勢約為1.5伏。鉛蓄電池最為常用,其極板是用鉛合金製成的格柵,電解液為稀硫酸。兩極板均覆蓋有硫酸鉛。但充電後,正極處極板上硫酸鉛轉變成二氧化鉛,負極處硫酸鉛轉變成金屬鉛。放電時,則發生反方向的化學反應。鉛蓄電池的電動勢約為2伏,常用串聯方式組成6伏或12伏的蓄電池組。電池放電時硫酸濃度減小,可用測電解液比重的方法來判斷蓄電池是否需要充電或者充電過程是否可以結束。鉛蓄電池的優點是放電時電動勢較穩定,缺點是比能量(單位重量所蓄電能)小,對環境腐蝕性強。由正極板群、負極板群、電解液和容器等組成。充電後的正極板是棕褐色的二氧化鉛(PbO2),負極板是灰色的絨狀鉛(Pb),當兩極板放置在濃度為27%~37%的硫酸(H2SO4)水溶液中時,極板的鉛和硫酸發生化學反應,二價的鉛正離子(Pb2+)轉移到電解液中,在負極板上留下兩個電子(2e-)。由於正負電荷的引力,鉛正離子聚集在負極板的周圍,而正極板在電解液中水分子作用下有少量的二氧化鉛(PbO2)滲入電解液,其中兩價的氧離子和水化合,使二氧化鉛分子變成可離解的一種不穩定的物質——氫氧化鉛〔Pb(OH4〕)。氫氧化鉛由4價的鉛正離子(Pb4+)和4個氫氧根〔4(OH)-〕組成。4價的鉛正離子(Pb4+)留在正極板上,使正極板帶正電。由於負極板帶負電,因而兩極板間就產生了一定的電位差,這就是電池的電動勢。當接通外電路,電流即由正極流向負極。在放電過程中,負極板上的電子不斷經外電路流向正極板,這時在電解液內部因硫酸分子電離成氫正離子(H+)和硫酸根負離子(SO42-),在離子電場力作用下,兩種離子分別向正負極移動,硫酸根負離子到達負極板後與鉛正離子結合成硫酸鉛(PbSO4)。在正極板上,由於電子自外電路流入,而與4價的鉛正離子(Pb4+)化合成2價的鉛正離子(Pb2+),並立即與正極板附近的硫酸根負離子結合成硫酸鉛附著在正極上。隨著蓄電池的放電,正負極板都受到硫化,同時電解液中的硫酸逐漸減少,而水分增多,從而導致電解液的比重下降在實際使用中,可以通過測定電解液的比重來確定蓄電池的放電程度。在正常使用情況下,鉛蓄電池不宜放電過度,否則將使和活性物質混在一起的細小硫酸鉛晶體結成較大的體,這不僅增加了極板的電阻,而且在充電時很難使它再還原,直接影響蓄池的容量和壽命。鉛蓄電池充電是放電的逆過程。鉛蓄電池的工作電壓平穩、使用溫度及使用電流範圍寬、能充放電數百個循環、貯存性能好(尤其適於乾式荷電貯存)、造價較低,因而套用廣泛。採用新型鉛合金和電解液添加納米碳溶膠,可改進鉛蓄電池的性能。如用鉛鈣合金作板柵,能保證鉛蓄電池最小的浮充電流、減少添水量和延長其使用壽命;採用鉛鋰合金鑄造正板柵,則可減少自放電和滿足密封的需要。此外,開口式鉛蓄電池要逐步改為密封式,並發展防酸、防爆式和消氫式鉛蓄電池。鉛酸電池
鉛酸電池(VRLA),是一種電極主要由鉛及其氧化物製成,電解液是硫酸溶液的蓄電池。鉛酸電池放電狀態下,正極主要成分為二氧化鉛,負極主要成分為鉛;充電狀態下,正負極的主要成分均為硫酸鉛。
鉛晶蓄電池鉛晶蓄電池套用的是專有技術,所採用的高導矽酸鹽電解質是傳統鉛酸電池電解質的複雜性改型,無酸霧內化成工藝是定型工藝的革新。這些技術工藝均屬國內外首創,該產品在生產、使用及廢棄物中都不存在污染問題,更符合環保要求,由於鉛晶蓄電池用矽酸鹽取代硫酸液作電解質,從而克服了鉛酸電池使用壽命短,不能大電流充放電的一系列缺點,更加符合動力電池的必備條件,鉛晶電池也必將對動力電池領域產生巨大的推動作用。
鐵鎳蓄電池
也叫愛迪生電池。鉛蓄電池是一種酸性蓄電池,與之不同,鐵鎳蓄電池的電解液是鹼性的氫氧化鉀溶液,是一種鹼性蓄電池。其正極為氧化鎳,負極為鐵。電動勢約為1.3~1.4伏。其優點是輕便、壽命長、易保養,缺點是效率不高。
鎳鎘蓄電池
正極為氫氧化鎳,負極為鎘,電解液是氫氧化鉀溶液。其優點是輕便、抗震、壽命長,常用於小型電子設備。
銀鋅蓄電池
正極為氧化銀,負極為鋅,電解液為氫氧化鉀溶液。銀鋅蓄電池的比能量大,能大電流放電,耐震,用作宇宙航行、人造衛星、火箭等的電源。充、放電次數可達約100~150次循環。其缺點是價格昂貴,使用壽命較短。
燃料電池
一種把燃料在燃燒過程中釋放的化學能直接轉換成電能的裝置。與蓄電池不同之處,是它可以從外部分別向兩個電極區域連續地補充燃料和氧化劑而不需要充電。燃料電池由燃料(例如氫、甲烷等)、氧化劑(例如氧和空氣等)、電極和電解液等四部分構成。其電極具有催化性能,且是多孔結構的,以保證較大的活性面積。工作時將燃料通入負極,氧化劑通入正極,它們各自在電極的催化下進行電化學反應以獲得電能。燃料電池把燃燒反應所放出的能量直接轉變為電能,所以它的能量利用率高,約等於熱機效率的2倍以上。此外它還有下述優點:①設備輕巧;②不發噪音,很少污染;③可連續運行;④單位重量輸出電能高等。因此,它已在宇宙航行中得到套用,在軍用與民用的各個領域中已展現廣泛套用的前景。
 太陽電池片
太陽電池片把太陽光的能量轉換為電能的裝置。當日光照射時,產生端電壓,得到電流,用於人造衛星、宇宙飛船中的太陽電池是半導體製成的(常用矽光電池)。日光照射太陽電池表面時,半導體PN結的兩側形成電位差。其效率在百分之十以上,典型的輸出功率是5~10毫瓦每平方厘米。
溫差電池
兩種金屬接成閉合電路,並在兩接頭處保持不同溫度時,產生電動勢,即溫差電動勢,這叫做塞貝克效應(見溫差電現象),這種裝置叫做溫差電偶或熱電偶。金屬溫差電偶產生的溫差電動勢較小,常用來測量溫度差。但將溫差電偶串聯成溫差電堆時,也可作為小功率的電源,這叫做溫差電池。用半導體材料製成的溫差電池,溫差電效應較強。
核電池
把核能直接轉換成電能的裝置(核發電裝置是利用核裂變能量使蒸汽受熱以推動發電機發電,還不能將核裂變過程中釋放的核能直接轉換成電能)。通常的核電池包括輻射β射線(高速電子流)的放射性源(例如鍶-90),收集這些電子的集電器,以及電子由放射性源到集電器所通過的絕緣體三部分。放射性源一端因失去負電成為正極,集電器一端得到負電成為負極。在放射性源與集電器兩端的電極之間形成電位差。這種核電池可產生高電壓,但電流很小。它用於人造衛星及探測飛船中,可長期使用。
原電池
經一次放電(連續或間歇)到電池容量耗盡後,不能再有效地用充電方法使其恢復到放電前狀態的電池。特點是攜帶方便、不需維護、可長期(幾個月甚至幾年)儲存或使用。原電池主要有鋅錳電池、鋅汞電池、鋅空氣電池、固體電解質電池和鋰電池等。鋅錳電池分為乾電池和鹼性。製造最早而至今仍大量生產的原電池。有圓柱型和疊層型兩種結構。其特點是使用方便、價格低廉、原材料來源豐富、適合大量自動化生產。但放電電壓不夠平穩,容量受放電率影響較大。適於中小放電率和間歇放電使用。新型鋅錳乾電池採用高濃度氯化鋅電解液、優良的二氧化錳粉和紙板漿層結構,使容量和壽命均提高一倍,並改善了密封性能。鹼性鋅錳電池
以鹼性電解質代替中性電解質的鋅錳電池。有圓柱型和鈕扣型兩種。這種電池的優點是容量大,電壓平穩,能大電流連續放電,可在低溫(-40℃)下工作。這種電池可在規定條件下充放電數十次。
鋅汞電池
由美國S.羅賓發明,故又名羅賓電池。是最早發明的小型電池。有鈕扣型和圓柱型兩種。放電電壓平穩,可用作要求不太嚴格的電壓標準。缺點是低溫性能差(只能在0℃以上使用),並且汞有毒。鋅汞電池已逐漸被其他系列的電池代替。
鋅空氣電池
以空氣中的氧為正極活性物質,因此比容量大。有鹼性和中性兩種系列,結構上又有濕式和乾式兩種。濕式電池只有鹼性一種,用NaOH為電解液,價格低廉,多製成大容量(100安·小時以上)固定型電池供鐵路信號用。乾式電池則有鹼性和中性兩種。中性空氣乾電池原料豐富、價格低廉,但只能在小電流下工作。鹼性空氣乾電池可大電流放電,比能量大,連續放電比間歇放電性能好。所有的空氣乾電池都受環境濕度影響,使用期短,可靠性差,不能在密封狀態下使用。
固體電解質
以固體離子導體為電解質,分高溫、常溫兩類。高溫的有鈉硫電池,可大電流工作。常溫的有銀碘電池,電壓0.6伏,價格昂貴,尚未獲得套用。已使用的是鋰碘電池,電壓2.7伏。這種電池可靠性很高,可用於心臟起搏器。但這種電池放電電流只能達到微安級。
鹼性電池
鹼性電池是最成功的高容量乾電池,也是目前最具性能價格比的電池之一。鹼性電池是以二氧化錳為正極,鋅為負極,氫氧化鉀為電解液。其特性上較碳性電池來的優異,電容量大。化學方程式為:Zn+2MnO2+2H2O==2MnOOH+Zn(OH)2結構。
鋰電池
以鋰為負極的電池。它是60年代以後發展起來的新型高能量電池。按所用電解質不同分為:①高溫熔融鹽鋰電池;②有機電解質鋰電池;③無機非水電解質鋰電池;④固體電解質鋰電池;⑤鋰水電池。鋰電池的優點是單體電池電壓高,比能量大,儲存壽命長(可達10年),高低溫性能好,可在-40~150℃使用。缺點是價格昂貴,安全性不高。另外電壓滯後和安全問題尚待改善。大力發展動力電池和新的正極材料的出現,特別是磷酸亞鐵鋰材料的發展,對鋰電發展有很大幫助。
儲備電池
 可用水充電的電池
可用水充電的電池標準電池
最著名的是惠斯頓標準電池,分飽和型和非飽和型兩種。其標準電動勢為1.01864伏(20℃)。非飽和型的電壓溫度係數約為飽和型的1/4。
磷酸鐵鋰電池
電池七大優勢:一、超長壽命,長壽命鉛酸電池的循環壽命在300次左右,最高也就500次,磷酸鐵鋰電池的壽命至少在1000次以上。同質量的鉛酸電池是“新半年、舊半年、維護維護又半年”,最多也就1—1.5年時間,而磷酸鐵鋰電池在同樣條件下使用,將達到7-8年。綜合考慮,性能價格比將為鉛酸電池的4倍以上。二、使用安全,磷酸鐵鋰完全解決了鈷酸鋰和錳酸鋰的安全隱患問題,鈷酸鋰和錳酸鋰在強烈的碰撞下會產生爆炸對消費者的生命安全構成威脅,而磷酸鐵鋰以經過嚴格的安全測試即使在最惡劣的交通事故中也不會產生爆炸。三、可大電流2C快速充放電,在專用充電器下,1.5C充電40分鐘內即可使電池充滿,起動電流可達2C,而鉛酸電池現在無此性能。四、耐高溫,磷酸鐵鋰電熱峰值可達350℃—500℃而錳酸鋰和鈷酸鋰只在200℃左右。五、大容量。六、無記憶效應。七、綠色環保。磷酸鐵鋰電池也有其缺點:例如磷酸鐵鋰正極材料的振實密度較小,等容量的磷酸鐵鋰電池的體積要大於鈷酸鋰等鋰離子電池,因此在微型電池方面不具有優勢。
服務壽命
電池是一種化學物質,因而也是有一定服務壽命的,諸如乾電池(包括普通的鹼性電池)等一次電池是不能充電的,服務壽命當然只有一次。對於充電電池,一般我們以充電次數來衡量其服務壽命的長短。鎳鎘電池的循環使用壽命在300~700次左右,鎳氫電池的可充電次數一般為400~1000次,鋰離子電池為500~800次。充電電池的服務壽命不僅受製作電池採用的原料、製作工藝等因素的影響,還與電池的充放電方法及實際使用情況有密切關係。例如,某人於1985年開始使用的6節HITACHI (日立)鎳鎘電池,一直到現在還在繼續使用,只是電池容量有些降低了。看來,只要使用方法合理,充電電池是完全可以達到甚至大大超過標稱的服務壽命的。
性能參數
電池的主要性能包括額定容量、額定電壓、充放電速率、阻抗、壽命和自放電率。
 電池
電池額定電壓:電池在常溫下的典型工作電壓,又稱標稱電壓。它是選用不同種類電池時的參考。電池的實際工作電壓隨不同使用條件而異。電池的開路電壓等於正、負電極的平衡電極電勢之差。它只與電極活性物質的種類有關,而與活性物質的數量無關。電池電壓本質上是直流電壓,但在某些特殊條件下,電極反應所引起的金屬晶體或某些成相膜的相變會造成電壓的微小波動,這種現象稱為噪聲。波動的幅度很小但頻率範圍很寬,故可與電路中自激噪聲相區別。
充放電速率:有時率和倍率兩種表示法。時率是以充放電時間表示的充放電速率,數值上等於電池的額定容量 (安·小時)除以規定的充放電電流(安)所得的小時數。倍率是充放電速率的另一種表示法,其數值為時率的倒數。原電池的放電速率是以經某一固定電阻放電到終止電壓的時間來表示。放電速率對電池性能的影響較大。
阻抗:電池內具有很大的電極-電解質界面面積,故可將電池等效為一大電容與小電阻、電感的串聯迴路。但實際情況複雜得多,尤其是電池的阻抗隨時間和直流電平而變化,所測得的阻抗只對具體的測量狀態有效。
壽命:儲存壽命指從電池製成到開始使用之間允許存放的最長時間,以年為單位。包括儲存期和使用期在內的總期限稱電池的有效期。儲存電池的壽命有乾儲存壽命和濕儲存壽命之分。循環壽命是蓄電池在滿足規定條件下所能達到的最大充放電循環次數。在規定循環壽命時必須同時規定充放電循環試驗的制度,包括充放電速率、放電深度和環境溫度範圍等。
自放電率:電池在存放過程中電容量自行損失的速率。用單位儲存時間內自放電損失的容量占儲存前容量的百分數表示。
電池材料 2013年上半,電池級碳酸鋰的價格總體表現穩定。雖然原材料鋰輝石價格有所上漲,但是由於碳酸鋰行業的供需之間接近平衡,因此其價格未能實現上漲。鋰電正極材料鈷酸鋰的價格在低位實現企穩,我們認為除非鈷價因為全球的經濟形勢再次下跌,不然鈷酸鋰的價格應該保持穩定,再下跌的可能性較小。鎳鈷錳三元材料的價格在前5個月比較穩定,但是自6月以來有一波下跌,跌幅在3000元/噸左右。我們認為三元材料價格的下跌和行業淡季到來一些生產商清庫存的行為有關。就全年來看其價格有望總體穩定。總體看,鋰電材料和原材料行業的表現仍算穩定,全年有望維持這一態勢。2013年以來,鉛價持續下跌,對行業的影響中性。啟動和動力廢電瓶的價格受鉛價下滑影響也有所下滑,動力和啟動電池的極板加工費也有所下滑。總體看,鉛價在下半年也難有大的改觀,不會成為影響行業運行的關鍵因素。
測試項目
內部短路測試、持續充電測試、過充電、大電流充電、強迫放電、墜落測試、從高處墜落測試、穿透實驗、平面壓碎實驗、切割實驗、低氣壓內擱置測試、熱虐實驗、浸水實驗、灼燒實驗、高壓實驗、烘烤實驗、電子爐實驗。
電池型號
一般分為:1、2、3、5、7號,其中5號和7號尤為常用,所謂的AA電池就是5號電池,而AAA電池就是7號電池。AA、AAA都是說明電池型號的。AA就是我們通常所說的5號電池,一般尺寸為:直徑14mm,高度49mm;AAA就是我們通常所說的7號電池,一般尺寸為:直徑11mm,高度44mm。
 各種型號電池
各種型號電池AAA型號電池就比較常見,一般的MP3用的都是AAA電池,標準的AAA(平頭)電池高度43.6±0.5mm,直徑10.1±0.2mm。
AA型號電池就更是人盡皆知,數位相機,電動玩具都少不了AA電池,標準的AA(平頭)電池高度48.0±0.5mm,直徑14.1±0.2mm。
A型號電池不常見,這一系列通常作電池組裡面的電池芯,鎳氫電池,幾乎都是4/5A,或者4/5SC的電池芯。標準的A(平頭)電池高度49.0±0.5mm,直徑16.8±0.2mm。
SC型號也不常見,一般是電池組裡面的電池芯,多在電動工具和攝像機以及進口設備上能見到,標準的SC(平頭)電池高度42.0±0.5mm,直徑22.1±0.2mm。
C型號也就是二號電池,用途不少,標準的C(平頭)電池高度49.5±0.5mm,直徑25.3±0.2mm。
D型號就是一號電池,用途廣泛,民用,軍工,特異型直流電源都能找到D型電池,標準的D(平頭)電池高度59.0±0.5mm,直徑32.3±0.2mm。
N型號不常見,標準的N(平頭)電池高度28.5±0.5mm,直徑11.7±0.2mm。
F型號電池,現在是電動助力車,動力電池的新一代產品,大有取代鉛酸免維護蓄電池的趨勢,一般都是作電池芯。標準的N(平頭)電池高度89.0±0.5mm,直徑32.3±0.2mm。
大家注意到,(平頭)字樣,指的是電池正極是平的,沒有突起,使用做電池組點焊使用的電池芯,一般同等型號尖頭的(可以用作單體電池供電的),在高度上就多了0.5mm。以此類推,我不逐一解釋。還有,電池很多的時候並不是規規矩矩的“AAA,AA,A,SC,C,D,N,F”這些主型號,前面還時常有分數“1/3,2/3,1/2,2/3,4/5,5/4,7/5”,這些分數表示的是池體相應的高度,例如“2/3AA”就是表示高是一般AA電池的2/3的充電電池;再如“4/5A”就是表示高是一般A電池的4/5的充電電池。
還有一種型號表示方法,是五位數字,例如,14500,17490,26500,前兩位數字是指池體直徑,後三位數字是指池體高,例如14500就是指AA電池,即大約14mm直徑,50mm高。
電池保養
手機電池
手機電池就其製造材料來分有三大類:鎳鎘電池、鎳氫電池、鋰離子電池。其中鎳鎘電池是第一代手機電池,它容量較低,有記憶效應,需要經常放電來維持容量,並且製造材料存在環境污染,目前這種電池已基本淘汰。第二代的鎳氫電池容量較高,無記憶效應,製造材料對環境污染很少,人們習慣稱其為環保電池。
 手機電池
手機電池鑑別真假鋰電池,在非專業的條件下,可以採用以下的方法:同等容量的電池,鋰電池比鎳氫、鎳鎘電池手感要輕;用鋰電池專用充電器對電池進行充電,若充電過程中電池發熱,則是鎳氫、鎳鎘電池,若溫度無大的變化,則是鋰電池;將電池正、負極“瞬間”短路後使用,如該電池“沒電”則是鋰電池,若仍“有電”則是鎳氫、鎳鎘電池。
在使用鋰電池中應注意的是,電池放置一段時間後則進入休眠狀態,此時容量低於正常值,使用時間亦隨之縮短。經過3—5次充電可激活電池,恢復正常容量。當電池無意間短路時,鋰電池內部保護電路會切斷供電迴路以確保使用者的安全,將電池取出重新充電便可恢復。
購買鋰電池,應選擇有售後服務,國際、國家認同的品牌電池,此種電池採用優質的原材料,具有完善的保護電路,外殼精美、耐磨、有防偽晶片,並與手機配合良好,可以達到良好的通訊效果。
筆記本電池
從電池的材料說起,目前筆記本電腦使用的電池主要分三種:1.鎳鉻電池、2.鎳氫電池、3.鋰電池;它們一般表示為:鎳鎘NI-CD、鎳氫NI-MH、鋰電LI。
筆記本電池維護:
1、激活新電池
廠商通用的做法是新筆記本在第一次開機時電池應帶有3%的電量,此時,應該先不使用外接電源,而是把電池裡的余電用盡,直至關機,然後再用外接電源充電。然後還要把電池的電量用盡後再充,充電時間一定要超過12小時,反覆做三次,以便激活電池。
2、儘量減少使用電池的次數
電池的充放電次數直接關係到壽命,每充一次,電池就向退役前進了一步。建議大家儘量使用外接電源,使用外接電源時應將電池取下。如果經常在一天中多次插拔電源,且筆記本電腦裝有電池,對電池的損壞更大。因為每次外接電源接入就相當於給電池充電一次,電池自然就折壽了。
3、電量用盡後再充電和避免充電時間過長
不管筆記本使用鋰電還是鎳氫電,一定要將電量用盡後再充(電量低於1%),這是避免記憶效應的最好方法。鋰電同樣會有記憶效應,只是它的記憶效應比鎳氫小一些罷了,只到電池的電量完全使用完之後才給它充電。部分的充、放電可能導致電池裡面各電芯的化學性能不一致,因而電池性能會退降。建議每隔幾個月對電池進行一次深度放電以最佳化電池的性能。具體做法就是用電池供電,一直使用到電池容量為0%(這時系統會自動進入休眠或待機狀態,根據BIOS中設定不同)。然後接上交流充電器一直充滿到100%為止。 電池經過長時間的存放,而電池都有一個自然的放電過程,已經自然放電完了,這並不影響電池的容量。第一次充電時,你應該連續地把電池充電到12個小時,並且循環地完全充、放電三次(參閱電池保養一節)以完全地喚醒新電池,如果這塊電池被存放了幾個月沒有使用,建議也對它進行三次完全的充、放電。如果一塊電池經連續12個小時之後或三次循環充放電之後仍然不能充電,這塊電池就不能使用需要更換了。
電動腳踏車電池
目前的電動腳踏車電池大部分都是鉛酸電池,主要注意事項如下:
1、用完後要及時充電,不能沒電狀態下長時間放置,否則電池極板就硫酸鹽化了;
2、綠燈亮了,表示電池可以使用或基本上充足電了,但離100%還有差距,建議每周或每兩周對電池作一次長時間充電,即綠燈亮了以後繼續充,時間可以控制在16小時左右,這樣可提高電池壽命;
3、注意檢查胎壓,夏天可適當低一些,其他季節可以搞一些,胎壓高比較省電;
4、將電完全放掉後再充電的觀念是不正確的,放電深度越大,電池使用壽命越短;
5、如果電電動腳踏車長時間不使用,要注意對電池充電後再放置,每月檢查一下電量;
6、如果不是電摩,最好不要加防盜器,效果不大,且增加電池的負擔;
7、如果你每天騎行的距離為15公里左右,估計你的電池可以使用2年;
8、如果充電中發現電池特別熱,趕快去檢修。
電動腳踏車用電池的維護保養
(1)電池在電動腳踏車上的安裝要牢固,以防騎行時電池受震動損壞。
(2)經常清除電池盒上的灰塵、污物,注意保持電池乾燥、清潔,以防電池自行放電。
(3)電池不要靠近高溫熱源。高溫季節,嚴禁在陽光直接暴曬(夏季存車時尤其要注意)。充電時要注意良好通風。
(4)電動腳踏車剛啟動時,要用腳踏助力啟動,以免放電電流過大而損壞電池;騎行時,要注意不能讓電池過放電,過放電容易引起電池嚴重虧電,從而大大的縮短其使用壽命。
(5)電動腳踏車的載重量過大,必然導致電機電流的增大,引起電池過放電,電池早期衰減,嚴重影響電池的壽命。我們公司推出了大功率電機配置大容量電池的電動車,目的是為了解決出行途中經常遇到的大坡度問題。但有些消費者一味追求電動腳踏車的載重能力,尤其是騎車帶人,如下面的圖片所示,不僅嚴重違反了交通法規,對電動腳踏車本身的維護是不利的。
(6)電池在使用過後即可充電,隨用隨充可保證下一次出行的順利。電池不用時應充足電後貯存,至少3個月充電補充電一次,以免電池造成不可逆硫酸鹽化。
(7)如發現電池破裂,電液滲漏是,應更換電池,以免造成酸液腐蝕。
(8)電池的電解液具有腐蝕性,請勿沾到皮膚及衣服上,更忌濺入眼內。如遇上述情況,要立即用清水沖洗,並立即送往醫院診治。
選購使用
 鎳鎘電池
鎳鎘電池(1)首先應根據電器的要求,選擇電池類型和規格尺寸,並根據用電器具耗電大小和特點,決定購買哪一種類型的電池,如BP機一般選用鹼性鋅錳電池,遙控器一般選用普通鋅錳電池就可滿足使用要求;(2)優選電池行業管理部門推薦的產品,購買市場銷量大、品質上乘的名牌電池;
(3)注意查看電池的保質期,購買近期生產的電池,對於那些採用代嗎表明保質期的電池一般購買時難以辨認,應加詢問;
(4)注意查看電池外觀,有無漏液跡象;
(5)商標上應標明生產廠家、電池極性、電池型號、公稱電壓、商標等,購買鹼錳電池時應看型號或有無ALKALINE或LR字樣。 選擇電池時重要的考慮事項有:
①電他類型原電池、二次電池,或貯備系統;
②電化學體系優點、缺點以及電池特點與設備主要要求相匹配;
③電壓標稱或工作電壓、最大最小允許電壓、電壓調節、放電曲線圖、啟動時間、電壓滯後;
④負載電流和負載曲線恆電流、恆電阻、恆功率或其他,負載電流或單值負載、可變負載、脈衝負載;
③循環工作制連續或間斷,如果需要採取循環工作制;
⑥溫度要求要求的工作溫度範圍;
⑦使用壽命要求的工作時間;
⑧物理要求尺寸、形狀、質量,極端;
⑨貯存壽命激活/貯備電池體系,貯存期間的荷電量,貯存時間隨溫度、濕度和其他條件而變化;
⑩充放電循環(可充式電池)浮充電或循環使用,要求的循環次數,充電電源實用性和特點,充電效率;
⑧環境條件振動、衝擊、離心鏇轉、加速度等,大氣條件(壓力、濕度等);
⑩安全性和可靠性允許的變化率、失效率,無除氣或無泄漏,採用了潛在的有毒有害物質,排出氣體或液體類型、高溫等,在苛刻的有潛在危險的條件下工作,環境友好性介不同尋常或苛刻的。工作條件相當長期或極端溫度下的貯存、擱置或工作;特殊套用下的高可靠性,貯備電池的快速反應、無電壓滯後現象,電池組特殊封裝(壓力容器等),非常規力學性能要求如強衝擊或加速度、非磁性等;
⑩維護和補給電池組易買進、易得到、易傳送、易更換,具有充電設備,特殊的運輸方式,必需的回收或處置程式;
⑩成本初始成本,操作或循環成本,使用危險或有害的(高成本)材料。
存放電池
 電池
電池(1)電池存放區應清潔、涼爽、通風;
(2)溫度應在10~30℃之間,一般不應超過40℃;相對濕度一般不大於65%為宜。
(3)存放時間不易過長,存放時應排列整齊,切勿正、負極相連,造成電池的短路。
使用電池注意事項
(1)檢查電器和電池接觸件是否清潔,必要時用濕布擦淨,待乾燥後按正確極性裝入;
(2)不要將新舊電池混用,同一種型號但不同種類的電池也不能混用;
(3)不能用加熱、充電或其它的方法使一次電池再生;
(4)不能將電池短路;
(5)不要拆卸電池、不要加熱電池;
(6)用電器具使用後應切斷開頭,長期不用應取出電池。
廢電池處理
2003年11月正式公布的《廢電池污染防治技術政策》澄清了人們在廢舊電池處理上的一系列認識誤區。這一政策還禁止對已收集的各種廢電池進行焚燒處理 。由國家環境保護總局和國家發展與改革委員會、建設部、科技部、商務部聯合制定並於2003年10月9日出台的《廢電池污染防治技術政策》是一份指導性檔案,自發布之日起實施。國家環保總局於11月27日上午召開新聞發布會,正式對外公布了這一技術政策。它適用於廢電池的分類、收集、運輸、綜合利用、貯存和處理處置等全過程污染防治的技術選擇,指導相應設施的規劃、立項、選址、施工、運營和管理,引導相關環保產業的發展。
廢電池污染防治技術政策 1. 總則1.1 為引導廢電池環境管理和處理處置、資源再生技術的發展,規範廢電池處理處置和資源再生行為,防止環境污染,促進社會和經濟的可持續發展,根據《中華人民共和國固體廢物污染環境防治法》等有關法律、法規、政策和標準,制定本技術政策。本技術政策隨社會經濟、技術水平的發展適時修訂。 1.2 本技術政策所稱廢電池包括下述廢物: 已經失去使用價值而被廢棄的各種一次電池(包括扣式電池)、可充電電池等; 已經失去使用價值而被廢棄的鉛酸蓄電池以及其他蓄電池等; 已經失去使用價值而被廢棄的各種用電器具的專用電池組及其中的單體電池; 上述各種電池在生產、運輸、銷售過程中產生的不合格產品、報廢產品、過期產品等; 上述各種電池在生產過程中產生的混合下腳料等混合廢料;其他廢棄的化學電源。 1.3 本技術政策適用於廢電池的分類、收集、運輸、綜合利用、貯存和處理處置等全過程污染防治的技術選擇,並指導相應設施的規劃、立項、選址、設計、施工、運營和管理,引導相關產業的發展。 1.4 廢電池污染控制應該遵循電池產品生命周期分析的基本原理,積極推行清潔生產,實行全過程管理和污染物質總量控制的原則。 1.5 廢電池污染控制的重點是廢含汞電池、廢鎘鎳電池、廢鉛酸蓄電池。逐漸減少以至最終在一次電池生產中不使用汞,安全、高效、低成本收集、回收或安全處置廢鎘鎳電池、廢鉛酸蓄電池以及其他對環境有害的廢電池。 1.6 廢氧化汞電池、廢鎘鎳電池、廢鉛酸蓄電池屬於危險廢物,應該按照有關危險廢物的管理法規、標準進行管理。 1.7 鼓勵開展廢電池污染途徑、污染規律和對環境影響小的新型電池開發的科學研究,確定相應的污染防治對策。 1.8 通過宣傳和普及廢電池污染防治知識,提高公眾環境意識,促進公眾對廢電池管理及其可能造成的環境危害有正確了解,實現對廢電池科學、合理、有效的管理。 1.9 各級人民政府應制定鼓勵性經濟政策等措施,加快符合環境保護要求的廢電池分類收集、貯存、資源再生及處理處置體系和設施建設,推動廢電池污染防治工作。 1.10 本技術政策遵循《危險廢物污染防治技術政策》的總體原則。 2.電池的生產與使用 2.1 制定有關電池分類標識的技術標準,以利於廢電池的分類收集、資源利用和處理處置。電池分類標識應包括下述內容: 需要回收電池的回收標識; 需要回收電池的種類標識; 電池中有害成分的含量標識。 2.2 電池製造商和委託其他製造商生產使用自己所擁有商標電池的商家,應當在其生產的電池上按照國家標準標註標識。 使用專用內置電池的器具生產商應該在其生產的產品上按照國家標準標註電池分類標識。 2.3 電池進口商應該要求國外製造商(或經銷商)在出口到我國的電池上按照中國國家標準標註標識,或由進口商在其進口的電池上貼上按照中國國家標準標註的標識。 2.4 使用電池的器具在設計時應該採用易於拆卸電池(或電池組)的結構,並且在其使用說明書中明確電池的使用和安裝拆卸方法,以及提示電池廢棄後的處置方式。 2.5 根據國家有關規定禁止生產和銷售氧化汞電池。根據國家有關規定禁止生產和銷售汞含量大於電池質量0.025%的鋅錳及鹼性鋅錳電池;2005年1月1日起停止生產含汞量大於0.0001%的鹼性鋅錳電池。逐步提高含汞量小於0.0001%的鹼性鋅錳電池在一次電池中的比例;逐步減少糊式電池的生產和銷售量,最終實現淘汰糊式電池。 2.6依託技術進步,通過制定有關電池中鎘、鉛的最高含量的標準,限制鎘、鉛等有害元素在有關電池中的使用。鼓勵發展鋰離子和金屬氫化物鎳電池(簡稱氫鎳電池)等可充電電池的生產,替代鎘鎳可充電電池,減少鎘鎳電池的生產和使用,最終在民用市場淘汰鎘鎳電池。 2.7鼓勵開發低耗、高能、低污染的電池產品和生產工藝、使用技術。鼓勵電池生產使用再生材料。 2.8 加強宣傳和教育,鼓勵和支持消費者使用汞含量小於0.0001%的高能鹼性鋅錳電池;鼓勵和支持消費者使用氫鎳電池和鋰離子電池等可充電電池以替代鎘鎳電池;鼓勵和支持消費者拒絕購買、使用劣質和冒牌的電池產品以及沒有正確標註有關標識的電池產品; 3.收集 3.1 廢電池的收集重點是鎘鎳電池、氫鎳電池、鋰離子電池、鉛酸電池等廢棄的可充電電池(以下簡稱為廢充電電池)和氧化銀等廢棄的扣式一次電池(以下簡稱為廢扣式電池)。 3.2 廢一次電池的回收,應由回收責任單位審慎地開展。目前,在缺乏有效回收的技術經濟條件下,不鼓勵集中收集已達到國家低汞或無汞要求的廢一次電池。 3.3 下列單位應當承擔回收廢充電電池和廢扣式電池的責任: 充電電池和扣式電池的製造商; 充電電池和扣式電池的進口商; 使用充電電池或扣式電池產品的製造商; 委託其他電池製造商生產使用自己所擁有商標的充電電池和扣式電池的商家。 3.4 上述承擔廢充電電池和廢扣式電池回收責任的單位,應當按照自己商品的銷售渠道指導、組織建立廢電池的回收系統,或者委託有關的回收系統有效回收。充電電池、扣式電池和使用這些電池的電器商品的銷售商應當在其銷售處設立廢電池的分類回收設施予以回收,並按照有關標準設立明顯的標識。 3.5 鼓勵消費者將廢充電電池和廢扣式電池送到電池或電器銷售商店相應的廢電池回收設施中,方便銷售商回收。 3.6 回收後的批量廢電池應當分類送到具有相應資質的工廠(設施),進行資源再生或無害化處理處置。 3.7 廢電池的收集包裝應當使用專用的具有相應分類標識的收集裝置。 4.運輸 4.1 廢電池要根據其種類,用符合國家標準的專門容器分類收集運輸。 4.2 貯存、裝運廢電池的容器應根據廢電池的特性而設計,不易破損、變形,其所用材料能有效地防止滲漏、擴散。裝有廢電池的容器必須貼有國家標準所要求的分類標識。 4.3 在廢電池的包裝運輸前和運輸過程中應保證廢電池的結構完整,不得將廢電池破碎、粉碎,以防止電池中有害成分的泄漏污染。 4.4 屬於危險廢物的廢電池越境轉移應遵從《控制危險廢物越境轉移及其處置的巴塞爾公約》的要求;批量廢電池的國內轉移應遵從《危險廢物轉移聯單管理辦法》及其他有關規定。 4.5 各級環境保護行政主管部門應按照國家和地方制定的危險廢物轉移管理辦法對批量廢電池的流向進行有效控制,禁止在轉移過程中將廢電池丟棄至環境中,禁止將3.1中規定需要重點收集的廢電池混入生活垃圾中。 5.貯存 5.1 本政策所稱廢電池貯存是指批量廢電池收集、運輸、資源再生過程中和處理處置前的存放行為,包括在確定廢電池處理處置方式前的臨時堆放。 5.2 批量廢電池的貯存設施應參照《危險廢物貯存污染控制標準》(GB18597-2001)的有關要求進行建設和管理。 5.3 禁止將廢電池堆放在露天場地,避免廢電池遭受雨淋水浸。 6.資源再生 6.1 廢電池的資源再生工廠應當以廢充電電池和廢扣式電池的回收處理為主,審慎建設廢一次電池的資源再生工廠。 6.2 廢電池資源再生設施建設應當經過充分的技術經濟論證,保證設施運行對環境不會造成二次污染以及經濟有效地回收資源。 6.3 廢充電電池、廢扣式電池的資源再生工廠,應按照危險廢物綜合利用設施要求進行管理,取得危險廢物經營許可證後方可運行。廢一次電池和混合廢電池的資源再生工廠,應參照危險廢物綜合利用設施要求進行管理,在取得危險廢物經營許可證後運行。 6.4 廢電池再生資源工廠場址選擇應參照《危險廢物焚燒污染控制標準》(GB18484-2001)中的選址要求進行。 6.5 任何廢電池資源再生工廠在生產過程中,汞、鎘、鉛、鋅、鎳等有害成分的回收量與安全處理處置量之和,不應小於在所處理廢電池中這一有害成分總量的95%。 6.6 在資源再生工藝之前的任何廢電池拆解、破碎、分選工藝過程都應當在封閉式構築物中進行,排出氣體須進行淨化處理,達標後排放。不得對廢電池進行人工破碎和在露天環境下進行破碎作業,防止廢電池中有害物質無組織排放或逸出,造成二次污染。 6.7 利用火法冶金工藝進行廢電池資源再生,其冶煉過程應當在密閉負壓條件下進行,以免有害氣體和粉塵逸出,收集的氣體應進行處理,達標後排放。 6.8 利用濕法冶金工藝進行廢電池資源再生,其工藝過程應當在封閉式構築物內進行,排出氣體須進行除濕淨化,達標後排放。 6.9 廢電池的資源再生裝置應設定尾氣淨化系統、報警系統和應急處理裝置。 6.10 廢電池資源再生工廠的廢氣排放應當參照執行《危險廢物焚燒污染控制標準》(GB18484-2001)中大氣污染物排放限值。 6.11 廢電池資源再生工廠應該設定污水淨化設施。工廠排放廢水應當滿足《污水綜合排放標準》(GB8978-1996)和其他相應標準的要求。 6.12 廢電池資源再生工廠產生的工業固體廢物(包括冶煉殘渣、廢氣淨化灰渣、廢水處理污泥、分選殘餘物等)應當按危險廢物進行管理和處置。 6.13 廢電池資源再生工廠的人員作業環境應當滿足《工業企業設計衛生標準》(GBZ1—2002)和《工作場所有害因素職業接觸限值》(GBZ2—2002)等有關國家標準的要求。 6.14 鼓勵開展廢電池資源再生的科學技術研究,開發經濟、高效的廢電池資源再生工藝,提高廢電池的資源再生率。 7.處理處置 7.1 在對生活垃圾進行焚燒和堆肥處理的城市和地區,宜進行垃圾分類收集,避免各種廢電池隨其他生活垃圾進入垃圾焚燒裝置和垃圾堆肥發酵裝置。 7.2 禁止對收集的各種廢電池進行焚燒處理。 7.3 對於已經收集的、目前還沒有經濟有效手段進行再生回收的一次或混合廢電池,可以參照危險廢物的安全處置、貯存要求對其進行安全填埋處置或貯存。在沒有建設危險廢物安全填埋場的地區,可按照危險廢物安全填埋的要求建設專用填埋單元,或者按照《危險廢物貯存污染控制標準》(GB18597-2001)的要求建設專用廢電池貯存設施,將廢電池裝入塑膠容器中在專用設施中填埋處置或貯存。使用的塑膠容器應該具有耐腐蝕、耐壓、密封的特性,必須完好無損,填埋處置的還應滿足填埋作業所需要的強度要求。 7.4 為便於將來廢電池再生利用,宜將已收集的廢電池進行分區分類填埋處置或貯存。 7.5 在對廢電池進行填埋處置前和處置過程中以及在貯存作業過程中,不應將廢電池進行拆解、碾壓及其他破碎操作,保證廢電池的外殼完整,減少並防止有害物質的滲出。 8.廢鉛酸蓄電池污染防治 8.1 廢鉛酸蓄電池的收集、運輸、拆解、再生冶煉等活動除滿足前列各章要求外,還應當遵從本章的要求。 8.2 廢鉛酸蓄電池應當進行回收利用,禁止用其它辦法進行處置。 8.3 廢鉛酸蓄電池應當按照危險廢物進行管理。廢鉛酸蓄電池的收集、運輸、拆解、再生鉛企業應當取得危險廢物經營許可證後方可進行經營或運行。 8.4 鼓勵集中回收處理廢鉛酸蓄電池。 8.5 在廢鉛酸蓄電池的收集、運輸過程中應當保持外殼的完整,並且採取必要措施防止酸液外泄。 廢鉛酸蓄電池收集、運輸單位應當制定必要的事故應急措施,以保證在收集、運輸過程中發生事故時能有效地減少以至防止對環境的污染。 8.6 廢鉛酸蓄電池回收拆解應當在專門設施內進行。在回收拆解過程中應該將塑膠、鉛極板、含鉛物料、廢酸液分別回收、處理。 8.7 廢鉛酸蓄電池中的廢酸液應收集處理,不得將其排入下水道或排入環境中。不能帶殼、酸液直接熔煉廢鉛酸蓄電池。 8.8 廢鉛酸蓄電池的回收冶煉企業應滿足下列要求: 鉛回收率大於95%; 再生鉛的生產規模大於5000噸/年。本技術政策發布後,新建企業生產規模應大於1萬噸/年; 再生鉛工藝過程採用密閉熔煉設備,並在負壓條件下生產,防止廢氣逸出; 具有完整廢水、廢氣的淨化設施,廢水、廢氣排放達到國家有關標準; 再生鉛冶煉過程中產生的粉塵和污泥得到妥善、安全處置。 逐步淘汰不能滿足上述基本條件的土法冶煉工藝和小型再生鉛企業。 8.9廢鉛酸蓄電池鉛冶煉再生過程中收集的粉塵和污泥應當按照危險廢物管理要求進行處理處置。 |
相關研究
 鎳鎘電池
鎳鎘電池如果你對電池的感覺還停留在手電筒里圓柱形乾電池的印象中,那實在是太落伍了。從最早我們熟知的鉛酸電池到後來的鎳鎘電池、鎳氫電池,再到如今手機里清一色的鋰電池,以及研發與實用並重的太陽能電池、燃料電池,結合人們的需要和當前的實際困難,各類電池正在發展中形成並體現著各自的特色,最大程度地展現了科技、實用等優點。
手機電池——風生水起
現在普遍採用的手機電池是鋰離子電池和鎳氫電池,前者幾乎覆蓋了中國和東亞、東南亞地區的所有手機電池,而後者在歐美地區還有少量的使用。鋰離子電池因為具有高工作電壓、小體積、無污染、長循環壽命且無記憶效應等優點被廣泛套用於手機行業。
傳統鋰離子電池正負極分別是由鋰和碳構成,被電解質浸沒包裹,通過電極中正負電荷的流動提供電流。由於鋰離子從一個電極抵達另一個電極需要一定的時間,因此充放電都很緩慢。尤其是充電,一般需要好幾個小時,因而限制了人們的使用。
今年3月份,美國麻省理工學院的兩位科學家發明了一種超級鋰電池,通過改變傳統電極的表面結構,加速了鋰離子釋放和吸收速度,使之比原來有了100倍的提升。也就是說,幾秒內就可以完成我們過去幾個小時的工作。而且,這兩位科學家所用的生產材料都是以前鋰電池常用的材料,並沒有新的消耗和負擔,為將來的實際套用奠定了良好的基礎。
研發人員說:“以秒計算而不是以小時計算的充電和放電過程,使得這項新型的電池技術將開啟新的技術套用之門,其中包括改變人們的生活方式。”該項研究結果已經發表於著名的《自然》雜誌上,並已獲2家公司授權,預計該項成果可在兩到三年內上市。
汽車電池——電動汽車不是夢
 電動汽車
電動汽車電動汽車技術可分為純電動汽車(EV)、混合電動汽車(HEV)和燃料電池汽車技術(FCEV)三個技術流派。現階段,混合動力汽車優勢較大,因為它對現有汽車技術的改進相對較少,可以起到很好的過渡作用。目前80%的混合動力汽車採用鎳氫動力電池,具有功率大、安全性好、循環利用率高、成本低、技術成熟等優點。不過,鎳氫電池容量有限,不利於汽車的長途運行。而鋰電池實現了大容量、高能量密度等特點,已經被眾多汽車廠商所青睞。但其不足之處在於安全性和穩定性不夠理想,以及鋰作為貴金屬生產成本也比較高。
於是全球第一大鎳氫電池和鎳鎘電池生產商比亞迪推出了新型的“鐵電池”。它採用鐵代替鋰,降低了生產成本,但電池容量和功率卻與鋰電池不相上下。而且它也大大提高了電池的穩定性,在燃燒和碰撞中不會發生爆炸,因此被寄予厚望。據稱,搭載了鐵電池的首輛比亞迪F3DM雙模電動車已於今年3月份在深圳的公路上跑了起來。或許這將真正實現只需插上電就可以跑汽車的夢想。
除了混合動力汽車外,燃料電池汽車是電動汽車的另一個重要方向。今年5月底,美國能源部出台政策,將撥款24億美元補助相關企業以推動美國電動車燃料電池的技術研發。燃料電池是將所供燃料的化學能直接變換為電能的一種能量轉換裝置,也就是說,化學能僅僅通過一個步驟就變為電能,而不是傳統的從化學能變為熱能,又從熱能變為電能,因此能量轉換率高達60%至80%。燃料電池具體原理是利用了水電解的逆反應,與其說它是個電池,倒不如說它是個“發電機”。只要通過連續地供給燃料和氧化劑,即可反應獲得連續電力。當燃料耗盡時,只需重新注滿燃料儲備庫即可。它的燃料很多樣化,像磷酸燃料電池、鹼性燃料電池、質子交換膜燃料電池、固體氧化物燃料電池、熔融碳酸鹽燃料電池及蓄熱式燃料電池等許多類型。比如利用甲醇作為燃料,相比於氫氣存儲更加方便安全,而相比於鋰離子能量可提高10倍。另外,科學家研製了一種新的過濾技術,安裝了上百個50微米大小的孔洞,可以將反應產生的二氧化碳等廢氣排到大氣中,清除反應副產品,進一步提高了效率。
今年2月份,索尼推出新款燃料電池,融合了鋰電池和燃料電池,實現了成本降低與持久續航的雙重目標。而且還有專門的智慧型控制晶片在電池工作時切換燃料電池和鋰電池部分,從而獲得最高的電池效率。
太陽能電池——環保持久
 太陽能電池
太陽能電池太陽能電池種類很多,目前套用最多、技術最成熟的是晶體矽太陽電池,目前占到市場份額的90%,它的轉化效率也最高,實驗室多晶矽太陽電池的一般效率已達到20.3%,工業上生產的多晶矽太陽電池的效率也可以達到13%-16%,而且生產技術成熟,質量穩定,即便使用20年,轉換效率相對於出廠時也僅僅下降20%。但由於多晶矽太陽電池的材料價格居高不下,加之工藝繁瑣,限制了其大規模推廣套用的要求。
為了進一步提高效率,降低成本,科學家採用了不同的材料和方法利用太陽能。2009年3月,澳大利亞莫納什大學(Monash University)的研究人員研發出了聚合物太陽能電池——一款超薄柔性太陽能電池。這種電池和一頁紙一樣薄,能隨意彎曲,非常輕便易於攜帶運輸。而且它部分透明,可以安裝在玻璃和窗戶上,拓寬了套用範圍。因為它能漂浮於水面上,所以既可以覆蓋水面又不影響正常發電。
而美國德拉瓦大學科研人員瞄準了新型的橫向光學聚焦系統。今年早些時候,他們宣布最新研製的超高效矽太陽能電池,在標準的陸地日光條件下,其太陽能轉換效率高達42.8%。相對於傳統太陽能電池,轉換效率高出約30%。該系統將吸收到的光束分配於不同的感光材料,能覆蓋全部太陽光譜,大大提高了對太陽光的利用率。而且,該系統還有一個靜止的寬接收角光學系統,可以接收更多的太陽光。這種固定化而不需要複雜跟蹤裝置的設備,使其更容易地被安裝於手提電腦等便攜設備。
據預測,未來幾年光伏產業的增長率至少是30%以上,市場前景廣闊。
而生命能源高科技攀升得更快,在卡通片《大力水手》中,菠菜是一種充滿了能量的食品。最近,科學家找到了一種從這種蔬菜中提取真能量的方法。利用這種方法,科學家發明了一種所謂的“菠菜電池”,這種電池的使用時間長達3周以上,可以套用在手機、筆記本電腦以及其它移動設備上。美國范德比爾特大學化工系學生設計出了一種新型太陽能面板。這種面板沒有使用昂貴的矽晶片,而是用菠菜的蛋白質做成。研究小組從菠菜中提取出光系統Ⅰ(植物葉綠體中將光能轉化為化學能的一種膜蛋白複合體,堅稱PSI),放在太陽能電池中作為光伏介質。單個電池尺寸為75*38毫米,製造兩塊太陽能面板需要24個這樣的電池。生物太陽能電池或許不久將走進我們的日常生活,別墅的屋頂上種點菠菜,給整個房間供電,天人合一妙不可言。
活的電池——生物技術完美體現
除了剛才提到的已產業化的鋰電池、燃料電池和太陽能電池等新型電池,科研人員還在積極研發其他類型的電池。比如從生命當中汲取靈感,製備了“活的”生物電池。在今年2月的“FCexpo2009國際氫·燃料電池展”上,索尼公司展示了相當前沿的糖生物電池。在現場演示中,只需注入普通的可樂就可以發電。這種電池是利用酶分解葡萄糖,提取電子和氫離子進行發電。早在2007年,索尼公司就曾經發布了一款用葡萄糖(Glucose)做能量來源的生物電池,它以酶為催化劑,從碳水化合物如葡萄糖中產生電力。在今年的新款中,單位體積功率密度提高了1倍,從50mW/40cc提升為70mW/28cc,以前4節電池才能驅動的Walkman揚聲器現在只需3節即可。這種電池更加環保,產物是水,而且酶可以再生,降低了價格。索尼公司看準了生物電池的光明前景,準備在續航能力等方面再加大投入研發,一場電子設備的革命正悄悄來臨。或許將來的某一天,我們手中的可樂也可以幫助自己的汽車行駛幾百公里。
保護技巧
許多寒冷天氣下拍攝的問題是沒有採取正確的程式。有三種不同的情況:1、從溫暖舒適的房間或者汽車中取出相機進入寒冷的戶外,要怎么處理。2、在寒冷的戶外拍攝要怎么做。3、相機回到溫暖舒適的房間或車裡要如何處理。
而戶外的主要問題是電池的電力的喪失。相機電池產生電能的物理和化學方法在低溫下都可能失效。在今天,所有依靠電池動力的自動相機,是一個相當嚴重問題。當拿著照相機和閃光燈進入低溫環境的時候,到電池電力的喪失。
應對的辦法是:首先要讓照相機和閃光燈儘可能的保溫,在戶外儘量把它們放在貼近身體的地方,比如外套裡面。除了短暫的拍照,儘量用體溫給它們保持溫度。另外也可以使機械快門,潤滑油被凍住而無法工作的可能也會大大降低。然後考慮到在寒冷中電池力的喪失。外出時,要儘可能多帶些備用電池。也儘量貼近身體保存,比如放在有利於吸收體溫的襯衣的口袋。當相機或閃光燈電池開始失效時,能及時更換溫暖的新電池。
在室外了,目標還是儘量保持相機和閃光燈的溫度。比如當靜侯遠處小山上野生動物的出現。安放好三腳架,如果可能把相機放在懷裡,直到準備拍攝。在這種情況下用快裝雲台是非常方便的。當看到拍攝對象的時候,可以把相機快速準確的放在三腳架上。一隻冰冷的三腳架能夠繼續工作,但是,一台冰冷的照相機可能根本無法工作。一些非常耗電的數位照相機,在寒冷的天氣中經常迅速地突然失靈。辦法只有準備更多的電池。如果發現電池失效,一定要有備用的電池。
鋰離子電池
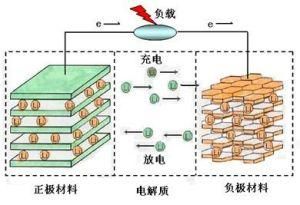 鋰電池原理
鋰電池原理LiCoO2(鈷酸鋰)+導電劑+粘合劑(PVDF)+集流體(鋁箔)正極
2.0負極構造
石墨+導電劑+增稠劑(CMC)+粘結劑(SBR)+集流體(銅箔)負極
3.0工作原理
3.1充電過程:一個電源給電池充電,此時正極上的電子e從通過外部電路跑到負極上,正鋰離子Li+從正極“跳進”電解液里,“爬過”隔膜上彎彎曲曲的小洞,“游泳”到達負極,與早就跑過來的電子結合在一起。
正極上發生的反應為:LiCoO2=充電=Li1-xCoO2+Xli++Xe(電子)
負極上發生的反應為:6C+XLi++Xe=====LixC6
3.2電池放電過程
放電有恆流放電和恆阻放電,恆流放電其實是在外電路加一個可以隨電壓變化而變化的可變電阻,恆阻放電的實質都是在電池正負極加一個電阻讓電子通過。由此可知,只要負極上的電子不能從負極跑到正極,電池就不會放電。電子和Li+都是同時行動的,方向相同但路不同,放電時,電子從負極經過電子導體跑到正極,鋰離子Li+從負極“跳進”電解液里,“爬過”隔膜上彎彎曲曲的小洞,“游泳”到達正極,與早就跑過來的電子結合在一起。
生活用品全盤點(一)
| 生活用品,指的是生活中常用的一些物品的統稱,例如牙膏,臉盆,衣架等 |

