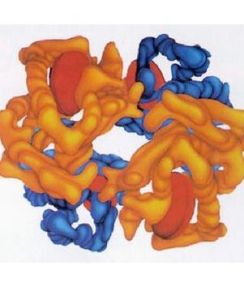
組成結構
 血紅蛋白
血紅蛋白血紅蛋白是脊椎動物紅血細胞的一種含鐵的複合變構蛋白,由血紅素和珠蛋白結合而成。其功能是運輸氧和二氧化碳,維持血液酸鹼平衡。也存在於某些低等動物和豆科植物根瘤中。分子量約67 000,含有四條多肽鏈,每個多肽鏈含有一個血紅素基團,血紅素中鐵為二價,與氧結合時,其化學價不變,形成氧合血紅蛋白。呈鮮紅色,與氧解離後帶有淡藍色。有多種類型:血紅蛋白A(HbA),α2β2,占成人血紅蛋白的98%;血紅蛋白A2(HbA2),α2δ2,占成人血紅蛋白的2%;血紅蛋白F(HbF),α2γ2,僅存在於胎兒血中;血紅蛋白H(HbH),β4,四個相同β鏈組成的四聚體血紅蛋白;血紅蛋白C(HbC),β鏈中Lys被Glu取代的血紅蛋白;血紅蛋白S(HbS),鐮刀狀細胞紅蛋白;血紅蛋白O2(HbO2,HHbO2),氧合血紅蛋白;血紅蛋白CO(HbCO),一氧化碳結合血紅蛋白。在沒有氧存在的情況下,四個亞基之間相互作用的力很強。氧分子越多與血紅蛋白結合力越強。中心離子鐵(II)進一步和蛋白質鏈中的組氨酸結合,成為五配位。既是配位中心,又是活性中心。血紅蛋白中鐵(II)能可逆地結合氧分子,取決於氧分壓。它能從氧分壓較高的肺泡中攝取氧,並隨著血液循環把氧氣釋放到氧分壓較低的組織中去,從而起到輸氧作用。一氧化碳與血紅蛋白的結合較氧強,即使濃度很低也能優先和血紅蛋白結合,致使通往組織的氧氣流中斷,造成一氧化碳中毒(使氧氣與血紅蛋白的結合能力下降,使人窒息而死亡)。
工作原理
血紅蛋白與氧結合的過程是一個非常神奇的過程。首先一個氧分子與血紅蛋白四個亞基中的一個結合,與氧結合之後的珠蛋白結構發生變化,造成整個血紅蛋白結構的變化,這種變化使得第二個氧分子相比於第一個氧分子更容易尋找血紅蛋白的另一個亞基結合,而它的結合會進一步促進第三個氧分子的結合,以此類推直到構成血紅蛋白的四個亞基分別與四個氧分子結合。而在組織內釋放氧的過程也是這樣,一個氧分子的離去會刺激另一個的離去,直到完全釋放所有的氧分子,這種有趣的現象稱為協同效應。
協同效應
 血紅蛋白病變
血紅蛋白病變血紅素分子結構由於協同效應,血紅蛋白與氧氣的結合曲線呈S形,在特定範圍內隨著環境中氧含量的變化,血紅蛋白與氧分子的結合率有一個劇烈變化的過程,生物體內組織中的氧濃度和肺組織中的氧濃度恰好位於這一突變的兩側,因而在肺組織,血紅蛋白可以充分地與氧結合,在體內其他部分則可以充分地釋放所攜帶的氧分子。可是當環境中的氧氣含量很高或者很低的時候,血紅蛋白的氧結合曲線非常平緩,氧氣濃度巨大的波動也很難使血紅蛋白與氧氣的結合率發生顯著變化,因此健康人即使呼吸純氧,血液運載氧的能力也不會有顯著的提高,從這個角度講,對健康人而言吸氧的所產生心理暗示要遠遠大於其生理作用。
除了運載氧,血紅蛋白還可以與二氧化碳、一氧化碳、氰離子結合,結合的方式也與氧完全一樣,所不同的只是結合的牢固程度,一氧化碳、氰離子一旦和血紅蛋白結合就很難離開,這就是煤氣中毒的原理,遇到這種情況可以使用其他與這些物質結合能力更強的物質來解毒,比如一氧化碳中毒可以用靜脈注射亞甲基藍的方法來救治。
綴合蛋白質
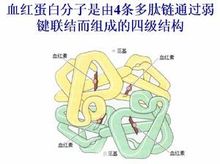 血紅蛋白
血紅蛋白血紅素和珠蛋白構成的綴合蛋白質,是脊椎動物血液的有色成分。其主要功能是運輸氧,也有維持血液酸鹼平衡的作用。血紅素是含2價鐵的卟啉化合物。鐵有6個配位鍵,其中4個與血紅素的環狀結構相連,並與之處在同一平面中。另2個配位鍵中的一個與蛋白質部分相連,還有1個則連線氧。珠蛋白含有4個亞基(α2β2),每個亞基連線1個血紅素輔基。人和許多動物血紅蛋白α鏈(含141個胺基酸殘基)和β鏈(含146個胺基酸殘基)的胺基酸序列已確定,也已用X射線衍射結構分析測定其四級結構。血紅蛋白基因的點突變導致異常血紅蛋白的產生。已發現數百種異常血紅蛋白,其中只有一小部分引起疾病發生,最常見也最了解的疾病是鐮刀形紅細胞貧血病。
在血紅蛋白中,血紅素輔基的Fe2+能可逆載氧,載氧時Fe2+的狀態為低自鏇,半徑較小,能嵌入卟啉環的平面內,呈六配位。而脫氧後,Fe2+呈高自鏇態,半徑較大,不能嵌入卟啉環的平面中,高出平面70-80pm,Fe-N距離220pm,為五配位。
生理意義
血紅蛋白的四級結構對其運氧功能有重要意義。它能從肺攜帶氧經由動脈血運送給組織,又能攜帶組織代謝所產生的二氧化碳經靜脈血送到肺再排出體外。現知它的這種功能與其亞基結構的兩種狀態有關,在缺氧的地方(如靜脈血中)亞基處於鉗制狀態,使氧不能與血紅素結合,所以在需氧組織里可以快速地脫下氧;在含氧豐富的肺里,亞基結構呈鬆弛狀態,使氧極易與血紅素結合,從而迅速地將氧運載走。亞基結構的轉換使呼吸功能高效進行。
氰化高鐵法:手指血20微升
自動血細胞分析儀:靜脈血1~2毫升,EDTAK2抗凝
生理情況下,人體每天均約有1/120紅細胞衰亡,同時,又有1/120的紅細胞產生,使紅細胞的生成與衰亡保持動態平衡。多種原因可使這種平衡遭到破壞,導致紅細胞和血紅蛋白數量減少或增多。
主要作用
血紅蛋白用於生化研究,培養流行性感冒病毒、淋球菌、兔熱病桿菌、鏈球菌、肺炎球菌等,色素。
正常參考值
成年男性:120~160g/L
成年女性:110~150g/L
新生兒:170~200g/L
青少年(兒童):110~160g/L
異常結果
紅細胞和血紅蛋白增多
 血紅蛋白
血紅蛋白由於某些原因使血漿中水分丟失,血液濃縮,使紅細胞和血紅蛋白含量相對增多。如連續劇烈嘔吐、大面積燒傷、嚴重腹瀉、大量出汗等;另見於慢性腎上腺皮質功能減退、尿崩症、甲狀腺功能亢進等。
2.絕對性增多:
由各種原因引起血液中紅細胞和血紅蛋白絕對值增多,多與機體循環及組織缺氧、血中促紅細胞生成素水平升高、骨髓加速釋放紅細胞有關。
(1)生理性增多:見於高原居民、胎兒和新生兒、劇烈勞動、恐懼、冷水浴等。
(2)病理性增多:由於促紅細胞生成素代償性增多所致,見於嚴重的先天性及後天性心肺疾病和血管畸形,如法洛四聯症、紫紺型先天性心臟病、阻塞性肺氣腫、肺源性心臟病、肺動-靜脈瘺以及攜氧能力低的異常血紅蛋白病等。
在另一些情況下,病人並無組織缺氧,促紅細胞生成素的增多並非機體需要,紅細胞和血紅蛋白增多亦無代償意義,見於某些腫瘤或腎臟疾病,如腎癌、肝細胞癌、腎胚胎瘤以及腎盂積水、多囊腎等。
紅細胞和血紅蛋白減少
一般成年男性血紅蛋白<120g/L,成年女性血紅蛋白<110g/L為貧血。根據血紅蛋白減低的程度貧血可分為四級。輕度:血紅蛋白>90g/L、中度:血紅蛋白90~60g/L、重度:血紅蛋白60~30g/L、極度:血紅蛋白<30g/L。
1.生理性減少:
3個月的嬰兒至15歲以前的兒童,因生長發育迅速而致造血原料相對不足,紅細胞和血紅蛋白可較正常人低10%~20%。妊娠中、後期由於孕婦血容量增加使血液稀釋,老年人由於骨髓造血功能逐漸減低,均可導致紅細胞和血紅蛋白含量減少。
2.病理性減少:
(1)紅細胞生成減少所致的貧血:
1)骨髓造血功能衰竭:再生障礙性貧血、骨髓纖維化等伴發的貧血。
2)因造血物質缺乏或利用障礙引起的貧血:如缺鐵性貧血、鐵粒幼細胞性貧血、葉酸及維生素B12缺乏所致的巨幼細胞性貧血。
(2)因紅細胞膜、酶遺傳性的缺陷或外來因素造成紅細胞破壞過多導致的貧血,如遺傳性球形紅細胞增多症、地中海性貧血、陣發性睡眠性血紅蛋白尿、異常血紅蛋白病、免疫性溶血性貧血、心臟體外循環的大手術及一些化學、生物因素等引起的溶血性貧血。
(3)失血:急性失血或消化道潰瘍、鉤蟲病等慢性失血所致的貧血。
偏高情況
血紅蛋白是高等生物體中負責運輸氧氣的一種蛋白質,主要存在於脊椎動物、某些無脊椎動物血液和豆科植物根瘤中。成年男性的血紅蛋白正常值是120~160g/L ,成年女性的正常值是110~150g/L,新生兒的正常值是170~200g/L,兒童的正常值是110~160g/L。
血紅蛋白偏高的原因有很多,大體上可以分為生理性升高和病理性升高,生理性升高常見於高原居民、胎兒和新生兒、劇烈運動、大量出汗、恐懼等情況;病理性升高常見於大面積燒傷、嚴重腹瀉、慢性腎上腺皮質功能減退、尿崩症、甲狀腺功能亢進、心肺疾病、血管畸形等疾病。
血紅蛋白偏高可以服用一些中藥來調理,調理身體,多鍛鍊身體,健康飲食。
測量方法
血紅蛋白測量方法一般為比色法。比色法測量的原理是被測試溶液濃度的改變,改變了溶液顏色的深淺。溶液濃度越高,溶液的顏色就越深,反之如果溶液的濃度越低,顏色就越淺。顏色的深淺直接影響了溶液對光線的吸收程度。溶液顏色越深吸收的光線越多,透過的光線越少。反之,溶液顏色越淺吸收的光線越少,透過的光線越多。通過測量透過比色池光線的強弱,可以間接測量出溶液的濃度。它的測試依據應該遵循朗伯一比耳定律,這就是光電比色法測試的基本原理。
根據測試原理和血紅蛋白測試機構的組成,影響血紅蛋白測試的主要因素有:
1、測試機構的光路系統
光路系統包括,光源燈供電電路,光源燈,透鏡組,濾光片,比色池,光電轉換器件(光電池,光電管)等。
如果光源供電不穩,濾波不好,波紋過大,供電電壓過低會影響光源燈的發光強度,和光源的穩定,影響測試的準確。此時按電路的維修程式,對電路進行調試修理,使之符合要求。光源燈暗、光源燈老化發光效率降低,影響測試值,會使測試值偏低。此時應該清潔燈泡,或更換新的光源燈。如果透鏡組髒,影響透鏡的透光程度,會影響測試值。此時要進行清潔透鏡組。濾光片使用日久會受潮、老化、生霉或髒,而影響測試,此時應該認真清洗濾光片。如果濾光片老化變質,會影響濾光片的中心波長和濾光片的頻寬。從而影響測試值,此時只能更換新的相同波長濾光片。
比色池髒、漏氣會影響測試值,因為髒不僅會影響透過比色池的光強度,如果比色池髒了並附著有氣泡,會使通過比色池的光產生反射或散射,嚴重影響測試結果。這時要對比色池認真清洗必要時用蛋白溶劑浸泡、沖洗排除故障。
光電器件表面有灰塵或髒物會影響光的接收和光電信號的轉換。此時要認真清洗,如果光電器件老化,只能進行更換。
2、液路系統
液路系統包括進液管、輸液管、泵管、電磁泵(或蠕動泵)及供電電路等部件。進液管髒、堵、裂隙會影響進液量,或吸入氣泡,嚴重影響測量。這時要清潔沖洗,除去堵塞,有裂隙漏氣要更換進液管。輸液管、泵管,主要是髒和堵或老化。髒堵要認真沖洗。對泵管,因為擠壓和摩擦容易發生粘連,或老化,嚴重的甚至磨破而漏氣,所以對泵管要及時檢查。損壞要及時更換。電磁泵(或蠕動泵)的故障主要是轉動不靈活,卡死不轉動,或供電電路故障。轉動不靈活或者卡死不轉動往往由於落入灰塵,與油形成油污所至。只要認真清洗可以排除故障。如供電電路問題按電路程式修理,泵本身損壞只能更換。綜上述血紅蛋白測量出現故障,往往出在光路和液路。因為現代電路比較成熟,使用的器件一般經過篩選故障率較低。所以血紅蛋白測量系統出現故障,一般對光路和液路進行檢查大多數故障可以排除。
檢查過程
取血液20μl,加入稀釋液5ml中,混勻,靜置5min後用分光光度計或比色計測定,於540nm波長,或綠色濾光片,用水校正吸光度為零點,測吸光度計算或查標準曲線,即得結果。
存在風險
感染的風險:如果使用了不潔針頭穿刺就有可能有感染的風險。