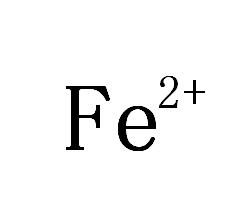亞鐵離子
 呈綠色的亞鐵離子
呈綠色的亞鐵離子例如氯化氫(HCI)、水(H2O)等。
物質特性
在化學上面叫亞的物質的化合價一定比其的最高的化學價低但是不一定是處於中間的化合價(如氯的化合價就有-10+1+3+5+7化學價+7價為它的最高的化合價只有+3才被稱為亞)。注意:亞鐵鹽水溶液大多為淺綠色,但是氫氧化亞鐵[Fe(OH)2]為難溶於水的白色固體。
化學組成
新鮮濾膜Fe2O3·5H2O或Fe(OH)3·H2O
銹球內部物質 Fe2O3·H2O或FeOOH 新鮮濾膜 Fe2O3·6H2O或Fe(OH)3·2H2O
為試驗結果。有新鮮濾膜的銹球,降鐵效果良好。而洗去濾膜的銹球則除鐵效果很差,並且具有與新濾料相同的特徵,它表明只有銹球表面疏鬆的濾膜物質才具有催化活性,而銹球內總密實的物質則沒有催化活性。濾料表面這種具有催化活性的疏鬆的鐵質濾膜,稱為鐵質活性濾膜。
地下水含鐵濃度14mg/l;溶解氧濃度7~8mg/l;濾速10m/h。
實驗製法
1、硫酸法:硫酸與母液混合,用蒸汽加熱至80℃時,將廢鐵屑溶解於反應液中,將反應生成的微酸性硫酸亞鐵溶液經澄清去除雜質後,再經冷卻結晶、離心脫水,製得硫酸亞鐵。其Fe+H2SO4→FeSO4+H2↑。2、鈦白副產法:將硫酸分解鈦鐵礦製造鈦白粉生產中經沉澱、冷凍、分離的副產硫酸亞鐵,經重結晶精製,製得硫酸亞鐵成品。其FeTiO2+2H2SO4→FeSO4+TiOSO4+TiOSO4+2H2O。
實驗表明
新鮮的鐵質活性濾膜的催化活性最強,隨著時間的延長,鐵質濾膜逐漸老化,其催化活性也逐漸減退。實驗是用成熟濾料進行的,實驗結果如圖5。停運幾天以後,成熟濾料的除鐵效能已大大降低,表明鐵質濾膜會隨時間逐漸老化而喪失其催化活性。銹球內部的密實物質,正是由老化的鐵質濾膜長期積累而成。所以,濾料表面鐵質活性濾膜的催化作用只有在連續的除鐵過程中才能實現。濾料表面的鐵質活性濾膜在過濾除鐵過程中得到新的補充,從而在原來的濾膜上不斷覆蓋上新的濾膜,這使濾膜始終保持新鮮而具有很高的催化活性。舊的濾膜則逐漸老化喪失催化活性,久之便成為濾料表面密實的附著物。濾料表面的鐵質活性濾膜的不斷更新,是銹砂接觸氧化除鐵過程正常進行的必要條件。已經明了,鐵質活性濾膜接觸氧化除鐵的過程,首先是濾膜離子交換吸附水中的亞鐵離子,可表示如下:
Fe(OH)3·2H2O+Fe2+= Fe(OH)2(OFE) ·2H2O++H+
當水中有溶解氧時,被吸附的亞鐵離子在活性濾膜的催化下迅速地水解和氧化,從而使催化劑得到再生,反應生成物又作為催化劑參與反應,所以鐵質活性濾膜接觸氧化除鐵是一個自動催化過程。
Fe(OH)2(Ofe) ·2H2O+1/4·O2+9/2 ·H2O= 2Fe(OH)3·2H2O+ H+
收集反衝洗水中的鐵泥進行分析,發現其中基本上不含亞鐵化合物。它表明被活性濾膜吸附的亞鐵離子能被迅速地氧化為高鐵。
按照鐵質活性濾膜接觸氧化除鐵是一個自動催化過程的概念,在過濾除鐵過程中被截留於濾層中的鐵質由於具有催化作用,應能使濾層的接觸氧化除鐵能力得到提高。情況確實如此。圖6為除鐵過程中,水的含鐵濃度沿濾層深度方向分布的變化情況。其中曲線1為濾層反衝洗後1小時的濃度分布情況,曲線2為反衝洗後36小時的情況。由圖可見,曲線2較曲線1的位置上移,表明隨著鐵質在濾層中的積累,濾層的接觸氧化除鐵能力有明顯的提高,它證實了鐵質活性濾膜接觸氧化除鐵是自動催化過程的結論。
五、成熟濾層的接觸氧化除鐵速率
水中的亞鐵離子在成熟濾層中被去除,經歷以下諸步驟:亞鐵離子由水中向濾料表面擴散;亞鐵離子被濾料表面的活性濾膜吸附;被吸附的亞鐵離子水解並被氧化,生成高鐵氫氧化物——鐵質活性濾膜。上述諸步驟中,反應速度最慢者將成為除鐵速率的控制步驟。實驗表明,亞鐵離子向濾料表面擴散可能是除鐵速率的控制因素。實驗還表明,濾料上活性濾膜只以外表面吸附水中的亞鐵離子。
根據菲克定律,亞鐵離子向濾膜表面擴散時,擴散速率與水中和濾膜表面的亞鐵離子濃度差(C-C’)成正比,與濾膜表面的邊界層厚度σ成反比。如果將擴散速率作為除鐵速率,並認為C’很小可忽略不計,則
-dc/dt=DS/D(C-C’)≈DS/σ·C (1)
式中 t——時間,t=ml/u;
l——濾層的厚度;
m——濾層孔隙度;
u——濾速;
D——擴散係數;
S——單位體積濾層中濾膜的外表面積,S=6a(1-m)/d;
d——濾料粒徑;
a——濾料的形狀係數;
σ——邊界層厚度;
C’——濾膜表面上的亞鐵離子濃度。
將上列各參數代入式(1)得
-dc/dι=βC (2)
β=6Dam(1-m)/ σdu (3)
式中β稱為濾層的接觸催化活性係數。
亞鐵製備
亞鐵製備與用途
製備 在實驗室中,可以用硫酸銅溶液與鐵反應獲得。 1、鋼鐵在電鍍或加塗層前,會先放入硫酸中酸洗,產生大量的硫酸亞鐵副產物。 2、以鈦鐵礦生產二氧化鈦時也會產生大量的硫酸亞鐵。 3、硫酸亞鐵還可從黃鐵礦的氧化,或鐵與硫酸反應製備(將稀硫酸加入鐵屑而得)。 將稀硫酸加入鐵屑而得。 結晶時的水溶液溫度<56.6"C:時為七水鹽,56.6~64.4℃時為四水鹽,>64.4℃時為一水鹽。 作用用途 用於制鐵鹽、氧化鐵顏料、媒染劑、淨水劑、防腐劑、消毒劑等; 醫藥上作抗貧血藥、局部收斂劑及補血劑,可用於子宮肌瘤引起的慢性失血; 分析試劑及制鐵氧體原料; 作為飼料添加劑的鐵強化劑; 農業上可用作農藥,能防治小麥黑穗病,蘋果和梨的疤痂病、果樹的腐爛病;食用級用作營養增補劑,如鐵質強化劑、果蔬發色劑。也可用作肥料,能除去樹幹的青苔及地衣。是製造磁性氧化鐵、氧化鐵紅和鐵藍無機顏料、鐵催化劑及聚硫酸鐵的原料。 此外還用作色譜分析試劑等。水含鐵度
地下水含鐵濃度。 地下水含鐵濃度14mg/l;溶解氧濃度7~8mg/l;濾速10m/h。亞鐵實驗
Fe2+從開始沉澱到沉澱完全時溶液的pH(常溫下):7.6~9.6。Fe(OH)2沉澱氧化為為Fe(OH)3時顏色變化為白色到灰綠色再到紅褐色。 在實驗室中如果想製取Fe(OH)2,可以以FeCl2和NaOH為原料。先煮沸FeCl2和NaOH溶液,再用長滴管吸入NaOH溶液並將其伸入FeCl2溶液液面以下,就可製得Fe(OH)2。注意事項
危險性
健康危害:對呼吸道有刺激性,吸入引起咳嗽和氣短。對眼睛、皮膚和黏膜有刺激性。誤服引起虛弱、腹痛、噁心、便血、肺及肝受損、休克、昏迷等,嚴重者可致死。 環境危害:對環境有危害,對水體可造成污染。急救措施
皮膚接觸:脫去污染的衣著,用大量流動清水沖洗。眼睛接觸:提起眼瞼,用流動清水或生理鹽水沖洗。就醫。 吸入:迅速脫離現場至空氣新鮮處。保持呼吸道通暢。如呼吸困難,給輸氧。如呼吸停止,立即進行人工呼吸。就醫。 食入:用水漱口,給飲牛奶或蛋清。就醫。消防措施
有害燃燒產物:氧化硫。 滅火方法:消防人員必須穿全身防火防毒服,在上風向滅火。滅火時儘可能將容器從火場移至空曠處。然後根據著火原因選擇適當滅火劑滅火。 應急處理 應急處理:隔離泄漏污染區,限制出入。建議應急處理人員戴防塵口罩,穿一般作業工作服。不要直接接觸泄漏物。 小量泄漏:避免揚塵,小心掃起,收集於乾燥、潔淨、有蓋的容器中。 大量泄漏:收集回收或運至廢物處理場所處置。包裝儲存
在夏天保質期30天,價格便宜,脫色效果好,絮凝礬花大,沉降快.外包裝分別有:50公斤和25公斤編織袋硫酸亞鐵廣泛用於漂染、電鍍廢水的處理,是一種高效的淨水絮凝劑,特別套用於漂染廢水的脫色處理,效果更佳;可用做一水硫酸亞鐵的原料,一水硫酸亞鐵廣泛套用於飼料業;是電鍍廢水高效絮凝劑聚合硫酸鐵的最主要原材料。操作注意事項:密閉操作,局部排風。防止粉塵釋放到車間空氣中。操作人員必須經過專門培訓,嚴格遵守操作規程。建議操作人員佩戴自吸過濾式防塵口罩,戴化學安全防護眼鏡,穿橡膠耐酸鹼服,戴橡膠耐酸鹼手套。避免產生粉塵。避免與氧化劑、鹼類接觸。配備泄漏應急處理設備。倒空的容器可能殘留有害物。
離子檢驗
方法1:觀察。亞鐵離子,是綠色的,看的出來。方法2:加入硫氰化鉀(不是硫氫化鉀),不顯血紅色.然後加入氯水,顯血紅色,則為亞鐵離子
反應離子方程式:
2Fe2++Cl2==2Fe3++2Cl-
Fe3++3SCN-==Fe(SCN)3(絡合反應,是可逆的,是檢驗三價鐵的特徵反應;二價鐵無此特性)
方法3:加入氫氧化鈉溶液,生成白色沉澱,白色沉澱迅速變成灰綠色,最後,變成紅褐色。這證明有鐵離子。
方法4:向溶液中加入酸性高錳酸鉀,若褪色,則有二價鐵,不褪色,則完全變質。
方法5:向溶液中加入醋酸鈉,由於二價鐵遇醋酸鈉無現象,而三價鐵則發生雙水解,產生沉澱,再結合方法3或4,則可判斷。區分鐵離子(Fe3+ )與亞鐵離子(Fe2+ ) 鐵離子和亞鐵離子,是中學化學中最重要的兩種離子。由於兩種離子可以互相轉化,且能與多種物質和離子發生反應,因此可以採用多種方法在單一溶液中以及在混合溶液中鑑定它們。
1、硫氰化鉀法
取兩種溶液各少量,分別滴入硫氰化鉀溶液(或硫氰化鈉、硫氰化銨等溶液),變血紅色的原溶液含鐵離子。
備註:遇硫氰根離子顯紅色是鐵離子檢驗的特徵反應,只要溶液變為血紅色,就可以證明溶液存在鐵離子,亞鐵離子的存在不干擾這種鑑定方法。
2、硫氰化鉀+氧化劑法
取兩種溶液各少量,分別滴入硫氰化鉀溶液(或硫氰化鈉、硫氰化銨等溶液),向不變色的溶液中加入少量氯水,變血紅色的原溶液中含有亞鐵離子。
備註:如果亞鐵離子中含有鐵離子,加入硫氰根離子後溶液立即顯紅色,導致後續變色不明顯,因此這種方法只能用來在不含鐵離子的溶液中鑑定亞鐵離子。
3、加鹼法
取兩種溶液各少量,分別加入鹼液(如氨水、氫氧化鈉、氫氧化鉀溶液),生成紅褐色沉澱的原溶液含有鐵離子。生成白色沉澱並立即轉變為綠色,最後變為紅褐色的原溶液含有亞鐵離子。
備註:這種方法需要離子的濃度較高,而且易受其它金屬離子(如鎂離子,銅離子)干擾,現象並不明顯,不適合從未知成分的溶液中鑑定兩種離子。
3.赤血鹽法
取兩種溶液各少量,分別滴入赤血鹽(鐵氰化鉀)溶液,出現藍色沉澱的原溶液含亞鐵離子,無藍色沉澱生成的原溶液含鐵離子。
備註:這是亞鐵離子檢驗的特徵反應,只要溶液出現藍色沉澱,就可證明溶液中存在亞鐵離子。鐵離子存在不干擾亞鐵離子鑑定。
4.苯酚法
取兩種溶液各少量,分別滴入幾滴苯酚溶液,變紫色的原溶液含有鐵離子。
備註:鑑定鐵離子的特徵反應之一,不同的酚有不同的顏色。亞鐵離子的存在不干擾鐵離子的鑑定。
5.純鹼法
取兩種溶液各少量,分別滴入純鹼溶液,產生灰色沉澱的原溶液含有亞鐵離子,生成紅褐色沉澱的原溶液含有鐵離子。
備註:純鹼和亞鐵鹽生成碳酸亞鐵,和鐵鹽發生雙水解反應。本法易受其它金屬離子(如鎂離子,鋁離子)干擾,不適合從未知成分的溶液中鑑定兩種離子。
6、銅片法
取兩種溶液各少量,分別滴在銅片上,過一段時間後銅片腐蝕的原溶液含有鐵離子。
備註:這種鑑定方法可以鑑定所有強氧化性離子,所以專一性較差。如果溶液中存在亞鐵離子,可以推測溶液中不含有其它強氧化性離子,因此可用來在亞鐵離子存在時鑑定鐵離子是否存在。
7、碘化鉀澱粉試紙法
取兩種溶液各少量,分別滴加到碘化鉀澱粉試紙上,使試紙變藍的原溶液含有鐵離子。
備註:這種鑑定方法可以鑑定所有強氧化性離子,所以專一性較差。如果溶液中存在亞鐵離子,可以推測溶液中不含有其它強氧化性離子,因此可用來在亞鐵離子存在時鑑定鐵離子是否存在。
8、高錳酸鉀法
取兩種溶液各少量,分別加入酸性高錳酸鉀溶液中,振盪,高錳酸鉀溶液的紫色褪去的原溶液含有亞鐵離子。
備註:這種鑑定方法可以鑑定所有強還原性離子,所以專一性較差。如果溶液中存在鐵離子,可以推測溶液中不含有其它強還原性離子,因此可用來在鐵離子存在時判斷亞鐵離子是否存在。
9、溴水法
取兩種溶液各少量,分別滴入硫酸酸化的溴水中,振盪,能使溴水褪色的原溶液含有亞鐵離子。
備註:這種鑑定方法可以鑑定所有強還原性離子,所以專一性較差。如果溶液中存在鐵離子,可以推測溶液中不含有其它強還原性離子,因此可用來在鐵離子存在時判斷亞鐵離子是否存在。