基本解釋
結晶的解釋有1、物質從液態(溶液或溶融狀態)或氣態形成晶體的過程。
2、晶體,即原子、離子或分子按一定的空間次序排列而形成的固體。也叫結晶體。
3、比喻珍貴的成果。例如:勞動的結晶/愛情的結晶。
詞語概念
基本信息
釋義:1.物質從液態(溶液或熔融狀態)或氣態形成晶體。
2.晶體,即原子、離子或分子按一定的空間次序排列而形成的固體。也叫結晶體。一般由純物質生成,具有固定的熔點,鏇光度。
3.比喻珍貴的成果。例如:勞動的結晶。
4。遊戲道具
基本解釋 
水的結晶
(1)[crystallize]∶物質從液態或氣態形成晶體
水的結晶
(2)[crystal]∶晶體
(3)[crystallization]∶比喻珍貴的成果,集體智慧的結晶。
詳細解釋
1.熱的飽和溶液冷卻後,溶質以晶體的形式析出這一過程叫結晶。2.即結晶體。
3.比喻珍貴的成果。
艾青《給烏蘭諾娃》詩:“不是天上的仙女,卻是人間的女神,比夢更美,比幻想更動人是勞動創造的結晶。”王朝聞《藝術創作有特殊規律》:“這是形象思維方法的卓越成就,是想像與思考的結晶。”
4、純金屬的結晶過程。
純金屬的結晶過程是在冷卻曲線上的水平線段內發生的。實驗證明:金屬結晶時,首先從液體金屬中自發形結晶
成一批結晶核心,與此同時,某些外來的難熔質點也可以充當晶核,形成非自發晶核;隨著時間的推移,已形成的晶核不斷長大,並繼續產生新的晶核,直到液體金屬全部消失,晶體彼此接觸為止。所以結晶過程就是不斷地形核和晶核不斷長大的過程。
 結晶
結晶專業解釋
結晶首先是一個地球物理概念,通過結晶形成的自然金、自然銀、自然銅其價值遠遠高出通過冶煉獲得的金、銀、銅。發育良好的礦物結晶體均價值連城。
由於中國工業文明較晚,大部分人對礦物結晶體不了解,上海市打造國際城市名片,已連續三年舉辦礦物結晶體展覽,爭取早日成為國際有影響力的大展,向美國圖森礦物結晶展、德國慕尼黑礦物結晶展、法國聖瑪麗礦物結晶展看齊。
介紹
從液態(溶液或熔融物)或氣態原料中析出晶體物質,是一種屬於熱、質傳遞過程的單元操作。從熔融體析出晶體的過程用於單晶製備,從氣體析出晶體的過程用於真空鍍膜,而化工生產中常遇到的是從溶液中析出晶體。根據液固平衡的特點,結晶操作不僅能夠從溶液中取得固體溶質,而且能夠實現溶質與雜質的分離,藉以提高產品的純度。早在5000多年前,人們已開始利用太陽能蒸濃海水製取食鹽。現在結晶已發展成為從不純的溶液里製取純淨固體產品的經濟而有效的操作。許多化工產品(如染料、塗料、醫藥品及各種鹽類等)都可用結晶法製取,得到的晶體產品不僅有一定純度,而且外形美觀,便於包裝、運輸、貯存和套用。
基本含義
原理
溶質從溶液中析出的過程,可分為晶核生成(成核)和晶體生長兩個階段,兩個階段的推動力都是溶液的過飽和度(溶液中溶質的濃度超過其飽和溶解度之值)。晶核的生成有三種形式:即初級均相成核、初級非均相成核及二次成核。在高過飽和度下,溶液自發地生成晶核的過程,稱為初級均相成核;溶液在外來物(如
結晶
對結晶操作的要求是製取純淨而又有一定粒度分布的晶體。晶體產品的粒度及其分布,主要取決於晶核生成速率(單位時間內單位體積溶液中產生的晶核數)、晶體生長速率(單位時間內晶體某線性尺寸的增加量)及晶體在結晶器中的平均停留時間。溶液的過飽和度,與晶核生成速率和晶體生長速率都有關係,因而對結晶產品的粒度及其分布有重要影響。在低過飽和度的溶液中,晶體生長速率與晶核生成速率之比值較大(見圖),因而所得晶體較大,晶形也較完整,但結晶速率很慢。在工業結晶器內,過飽和度通常控制在介穩區內,此時結晶器具有較高的生產能力,又可得到一定大小的晶體產品。晶體在一定條件下所形成的特定晶形,稱為晶習。向溶液添加或自溶液中除去某種物質(稱為晶習改變劑)可以改變晶習,使所得晶體具有另一種形狀。這對工業結晶有一定的意義。晶習改變劑通常是一些表面活性物質以及金屬或非金屬離子。
結晶方法
按產生過飽和度的手段分以下三種:①冷卻結晶。將溶液冷卻,使之成為過飽和。此法對於溶解度隨溫度降低而顯著減小的物系尤為適用。②蒸髮結晶。除去部分溶劑使溶液成為過飽和。此法適用於溫度變化對溶解度影響不大或具有逆溶解度(溶解度隨溫度下降而增大)的物系。③真空結晶。將溶液在真空下閃急蒸發,溶液在濃縮和冷卻雙重作用下達到過飽和,此法在工業結晶中套用最廣(見彩圖)。此外,還有鹽析結晶(向溶液中加入溶解度大的鹽類,以降低被結晶溶質的溶解度,使達到過飽和)等其他方法。通常的結晶過程是從揮發性溶液中提取不揮發性溶質。但某些相對揮發度很小而不宜採用精餾分離的液體混合物,可利用各組分熔點的差異,採取多級分步結晶法(反覆進行熔融和部分結晶的方法)加以提純或分離,如從間位、鄰位和對位二甲苯混合物中提取對位二甲苯。
結晶過程
結晶的確是一門學問,國內在結晶方面專家首推天津大學化工學院的王靜康院士。關於這方面的理論書籍不少,但是真正具體到每一類物質或每個物質,他們又不完全相同。共性的東西可能是理論上的,具體到每一類化合物的結晶過程的討論可能對大家最有幫助。溶劑的選擇(單一或複合)、結晶溫度,攪拌速度,攪拌方式,過飽和度的選擇,養晶的時間,溶媒滴加的方式和速率等等,另外,在溶解、析晶、養晶這些過程中,上述溫度、攪拌速度、時間多少、加入方式和速度還不完全一樣。所以諸多因素疊加在一起,更是覺得難度大。一般說來,先應該選擇主要的條件,使結晶過程能夠進行下去,得到晶體,然後再最佳化上述條件。條件成熟後,才能進行中試和生產。如果是進行理論研究可能著重點就不一樣了。如果是搞套用研究,那么溶劑相對來說不難選擇,關鍵點在於使用這種溶劑能否找到過飽和點,過飽和點區間是不是好控制。如果過飽和點不好選,或過飽和度不夠,很難析晶,更別提養晶了。這時可能要考慮複合溶媒,調整過飽和區間。所以我認為結晶過程最
主要的是析晶過程,這時候各個條件的控制最為重要。控制好析晶過程,結晶過程大概完成60%。
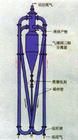 結晶
結晶養晶過程相對來說好控制一些,主要是按照最佳化參數,控制好條件,一般問題不大,放大過程中也基本不會出問題。如果搞基礎研究,物性還不是很清楚,結晶過程的研究可能花費的時間,精力較大。但一旦把整個過程搞明白,還是很有價值的。
結晶性能
從液態(溶液或熔融物)或氣態原料中析出晶體物質,是一種屬於熱、質傳遞過程的單元操作。從熔融體析出晶體的過程用於單晶製備,從氣體析出晶體的過程用於真空鍍膜,而化工生產中常遇到的是從溶液中析出晶體。根據液固平衡的特點,結晶操作不僅能夠從溶液中取得固體溶質,而且能夠實現溶質與雜質的分離,藉以提高產品的純度。早在5000多年前,人們已開始利用太陽能蒸濃海水製取食鹽。現在結晶已發展成為從不純的溶液里製取純淨固體產品的經濟而有效的操作。許多化工產品(如染料、塗料、醫藥品及各種鹽類等)都可用結晶法製取,得到的晶體產品不僅有一定純度,而且外形美觀,便於包裝、運輸、貯存和套用。
結晶知識
在結晶和重結晶純化化學試劑的操作中,溶劑的選擇是關係到純化質量和回收率的關鍵問題。選擇適宜的溶劑時應注意以下幾個問題:選擇的溶劑應不與欲純化的化學試劑發生化學反應。例如脂肪族鹵代烴類化合物不宜用作鹼性化合物結晶和重結晶的溶劑;醇類化合物不宜用作酯類化合物結晶和重結晶的溶劑,也不宜用作胺基酸鹽酸鹽結晶和重結晶的溶劑。
 結晶
結晶選擇的溶劑對欲純化的化學試劑在熱時應具有較大的溶解能力,而在較低溫度時對欲純化的化學試劑的溶解能力大大減小。
結晶機制
對欲純化的化學試劑中可能存在的雜質或是溶解度甚大,以便能使雜質在欲純化的化學試劑結晶和重結晶時留在母液中,在結晶和重結晶時不隨晶體一同析出;或是溶解度甚小,以便能使雜質在欲純化的化學試劑加熱溶解時,很少在熱溶劑溶解,在熱過濾時被除去。選擇的溶劑沸點不宜過於高,以免該溶劑在結晶和重結晶時附著在晶體表面不容易除盡。
用於結晶和重結晶的常用溶劑有:水、甲醇、乙醇、異丙醇、丙酮、乙酸乙酯、氯仿、冰醋酸、二氧六環、四氯化碳、苯、石油醚等。此外,甲苯

結晶
關於晶體的析出過濾得到的濾液冷卻後,晶體就會析出。用冷水或冰水迅速冷卻並劇烈攪動溶液時,可得到顆粒很小的晶體,將熱溶液在常溫條件下靜置使之緩緩冷卻,則可得到均勻而較大的晶體。
如果溶液冷卻後晶體仍不析出,可用玻璃抹摩控液面下的容器壁,也可加入晶種,或進一步降低溶液溫度(用冰水或其它冷凍溶液冷卻)。如果溶液冷卻後不析出晶體而得到油狀物時,可重新加熱,至形成澄清的熱溶液後,任其自行冷卻,並不斷用玻璃棒攪拌溶液,摩擦器壁或投人晶種,以加速晶體的析出。若仍有油狀物開始析出,應立即劇烈攪拌使油滴分散。

