理化性質
 草酸
草酸無色單斜片狀或稜柱體結晶或白色粉末、氧化法草酸無氣味、合成法草酸有味。150~160℃升華。在高熱乾燥空氣中能風化。
1g溶於7ml水、2ml沸水、2.5ml乙醇、1.8ml沸乙醇、100ml乙醚、5.5ml甘油,不溶於苯、氯仿和石油醚。0.1mol/L溶液的pH值為1.3。相對密度(d18.54)1.653。熔點101~102℃(187℃,無水)。低毒,半數致死量(兔,經皮)2000mg/kg。
官能團:—COOH(羧基)
溶液中離子組分:CO(草酸根離子),H(氫離子), HCO(草酸氫根離子)
CAS No.:144-62-7;6153-56-6(二水合物)
EINECS號 205-634-3
性狀:無色透明結晶或粉末。其晶體結構有兩種形態,即α型(菱形)和β型(單斜晶形)。無嗅,味酸。
熔點:α型,189.5℃,β型:182℃
沸點: [分子立體模型] 沸點150℃(升華)。
相對密度:1.653(二水物),1.9(無水物)。α型:1.900,β型:1.895
折射率:1.540
穩定性:189.5℃分解
溶解情況:易溶於乙醇。溶於水。微溶於乙醚。不溶於苯和氯仿。
化學性質
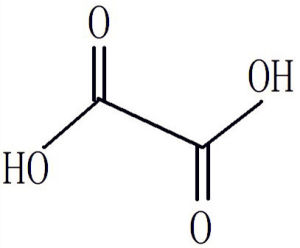 草酸結構
草酸結構草酸根有很強的配合作用,是植物源食品中另一類金屬螯合劑。當草酸與一些鹼土金屬元素結合時,其溶解性大大降低,如草酸鈣幾乎不溶於水。因此草酸的存在對必須礦質的生物有效性有很大影響;當草酸與一些過渡性金屬元素結合時,由於草酸的配合作用,形成了可溶性的配合物,其溶解性大大增加。
草酸在100℃開始升華,125℃時迅速升華,157℃時大量升華,並開始分解。
可與鹼反應,可以發生酯化、醯鹵化、醯胺化反應。也可以發生還原反應,受熱發生脫羧反應。無水草酸有吸濕性。草酸能與許多金屬形成溶於水的絡合物。
酸性
草酸的酸性比醋酸(乙酸)強10000 倍,是有機酸中的強酸。其一級電離常數Ka1=5.9×10^-2 ,二級電離常數Ka2=6.4×10^-5。具有酸的通性。能與鹼發生中和,能使指示劑變色,能與碳酸根作用放出二氧化碳。
例如:HCO+NaCO==NaCO+CO↑+HO
HCO+Zn==ZnCO+H↑
還原性
草酸根具有很強的還原性,與氧化劑作用易被氧化成二氧化碳和水。可以使酸性高錳酸鉀(KMnO4)溶液褪色,並將其還原成2價錳離子。這一反應在定量分析中被用作測定高錳酸鉀濃度的方法。草酸還可以洗去濺在布條上的墨水跡。
2KMnO+5HCO+3HSO==KSO+2MnSO+10CO↑+8HO
HCO+NaClO==NaCl+2CO↑+HO
不穩定性
草酸在189.5℃或遇濃硫酸會分解生成二氧化碳、一氧化碳和水。
HCO====CO↑+CO↑+HO
實驗室可以利用此反應來製取一氧化碳氣體。
草酸氫銨200度時分解為二氧化碳、一氧化碳、氨氣和水
毒性
草酸有毒。對皮膚、黏膜有刺激及腐蝕作用,極易經表皮、黏膜吸收引起中毒。空氣中最高容許濃度為1m g/m3。
酯化反應
乙二酸可以跟醇反應生成酯。比如乙二酸跟乙醇反應生成乙二酸二乙酯。
自然分布
草酸遍布於自然界,常以草酸鹽形式存在於植物如伏牛花、羊蹄草、酢漿草和酸模草的細胞膜,幾乎所有的植物都含有草酸鈣。草酸是植物特別是草本植物常具有的成分,多以鉀鹽或鈣鹽的形式存在。秋海棠、芭蕉中以游離酸的形式存在。
草酸在很多食品中都有少量存在,而在少數食品中含量很高。可可就屬於含量最高的食品之一,每100克可可中含有500毫克草酸;綠色蔬菜中的草酸含量一般很高,每100克菠菜含600毫克,大黃含500毫克,甜菜、花生、茶中也有較多的草酸。
常見草酸鹽
1、草酸鈉2、草酸鉀3、草酸鈣4、草酸亞鐵5、草酸銻6、草酸氫銨7、草酸鎂8、草酸鋰
檢測方法
按GB1626-88中規定的分析方法測試。
草酸含量(以H2C2O4*2H2O計)以酚酞為指示劑,用氫氧化鈉標準溶液滴定。硫酸根(以SO4計)試樣中加入碳酸鈉使草酸中硫酸根生成硫酸鹽。為熱使草酸及草酸鹽分解,殘留物溶液,加入氯化鋇溶液生成硫酸鋇,進行比濁。
灰分的測定按GB7531進行測定。
重金屬(以Pb計)按GB7531進行測定。
鐵(以FE計)按GB3049進行測定。
氯化物(以Cl計)在硝酸酸性溶液中,氯化物與硝酸銀生成氯化銀,而後進行比濁。
工業製法
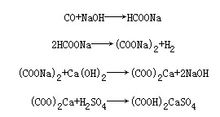 反應式
反應式草酸工業化生產方法主要有:甲酸鈉法、氧化法、羰基合成法、乙二醇氧化法、丙烯氧化法、一氧化碳偶聯法。
1.甲酸鈉法一氧化碳淨化後在加壓情況下與氫氧化鈉反應,生成甲酸鈉,然後經高溫脫氫生成草酸鈉,草酸鈉再經鉛化(或鈣化)、酸化、結晶和脫水乾燥等工序,得到成品草酸。一氧化碳與氫氧化鈉合成壓力一般為1.8-2.0MPa。脫氫溫度為400℃。
2.氧化法以澱粉或葡萄糖母液為原料,在礬觸媒存在下,與硝酸-硫酸進行氧化反應得草酸。廢氣中的氧化氮送吸收塔回收生成稀硝酸。
3.羰基合成法一氧化碳經提純到90%以上,在鈀催化劑存在下與丁醇發生羰基化反應,生成草酸二丁酯,然後通過水解得到草酸,此法分為液相法和氣相法兩種,氣相法反應條件較低,反應壓力為300-400kPa。而液相法反應壓力為13.0-15.0MPa。
4.乙二醇氧化法以乙二醇為原料,在硝酸和硫酸存在下,用空氣氧化而得。
5.丙烯氧化法 氧化過程分兩步進行。第一步用硝酸氧化,使丙烯轉化為α-硝基乳酸;然後進一步催化氧化得到草酸。第二步也可採用混酸為氧化劑。丙烯氧化法生產工業級草酸二水化合物,以丙烯計總收率大於90%。
原料消耗定額:焦炭(84%)510kg/t、硫酸(100%)950kg/t、燒鹼(100%)920kg/t。
自然界中草酸通常以鹽的形式存在於許多植物細胞膜中。從前工業上用木屑和強鹼在240~250℃共熔,首先製取草酸鹽,再經酸化即得草酸。後來,採用甲酸鈉脫氫法生產草酸。工業上取一氧化碳(如黃磷生產尾氣)經苛性鈉吸收後,製得甲酸鈉,後者在380℃下脫氫得到草酸鈉,再經石灰、硫酸處理,製成草酸。
具體用途
絡合劑、掩蔽劑、沉澱劑、還原劑。分析中用以檢定和測定鈹、鈣、鉻、金、錳、鍶、釷等金屬離子。顯微微晶分析檢驗鈉和其他元素。沉澱鈣、鎂、釷和稀土元素。校準高錳酸鉀和硫酸鈰溶液的標準溶液。漂白劑。助染劑。也可用來除去衣服上的鐵鏽建築行業在塗刷外牆塗料前、由於牆面鹼性較強應先塗刷草酸除鹼。
醫藥工業用於製造金黴素、土黴素、四環素、鏈黴素、冰片、維生素B12、苯巴比妥等藥物。印染工業用作顯色助染劑、漂白劑、醫藥中間體。塑膠工業用於生產聚氯乙烯、氨基塑膠、脲醛塑膠。
用作酚醛樹脂合成的催化劑,催化反應溫和,過程比較平穩,持續時間最長。草酸丙酮溶液能催化環氧樹脂固化反應,縮短固化時間。也用作合成脲醛樹脂、三聚氰胺甲醛樹脂的pH值調節劑。還可加入聚乙烯醇縮甲醛水溶性膠黏劑中提高幹燥速度和粘接強度。亦用作脲醛樹脂的固化劑、金屬離子螯合劑。可用作KMnO4氧化劑製備澱粉膠黏劑的促進劑,加快氧化速度,縮短反應時間。
作漂白劑
草酸主要用作還原劑和漂白劑,用於生產抗菌素和冰片等藥物以及提煉稀有金屬的溶劑、染料還原劑、鞣革劑等。
草酸還可用於鈷-鉬-鋁催化劑的生產、金屬和大理石的清洗及紡織品的漂白。
用於金屬表面清洗和處理,稀土元素提取、紡織印染、皮革加工、催化劑製備等。
作還原劑
在有機合成工業主要用於生產對苯二酚、季戊四醇、草酸鈷、草酸鎳、沒食子酸等化工產品。
塑膠工業用於生產聚氯乙烯、氨基塑膠、脲醛塑膠、漆片等。
染料工業用於製造鹽基品綠等。
印染工業可代替乙酸,用作色素染料的顯色助染劑、漂白劑。
醫藥工業用於製造金黴素、土黴素、四環素、鏈黴素、麻黃素。
此外,草酸還可用於合成各種草酸酯、草酸鹽和草醯胺等產品,而以草酸二乙酯及草酸鈉、草酸鈣等產量最大。
作媒染劑
草酸銻可作媒染劑,草酸鐵銨是印製藍圖的藥劑。
除銹功能
草酸可用來除銹。不過使用時要小心,草酸對不鏽鋼有較強的腐蝕性。濃度高的草酸也容易腐蝕手。並且生成的酸式草酸鹽溶解度很大,但有一定毒性。使用時,不要吃或喝就行了。 皮膚接觸草酸後,應及時用水清洗。
方法:到賣化學試劑的店裡買一瓶草酸,取一些,用溫水配成溶液,塗在銹漬上擦拭。然後用金相砂紙擦,最後噴塗油漆。賣草酸的店裡一般還賣些醫藥器械,玻璃儀器。
毒理學
急性毒性:大鼠經口LD50:7500mg/kg;小鼠腹腔LC50:270mg/kg;
刺激數據:皮膚-兔子500毫克/24小時輕度;眼-兔子0.25毫克/24小時重度
有腐蝕性,對皮膚和黏膜有刺激性,吸入蒸氣、粉塵會引起中毒,吞入後引起腸胃炎、嘔吐、腹瀉等症狀。成人最低致死量為71mg/kg。
生態學數據該物質對環境可能有危害,對水體應給予特別注意。該品具有強烈刺激性和腐蝕性。其粉塵或濃溶液可導致皮膚、眼或黏膜的嚴重損害。具有較強毒性和腐蝕性。草酸對人的最低致死量為71mg/kg,對成年人的致死量為15~30g。人若口服5g草酸及草酸即發生胃腸道炎、虛脫、抽搐和休克等症狀以至死亡。吸入草酸蒸氣發生慢性中毒者,有極度虛弱、鼻黏膜潰瘍、咳嗽、全身疼痛、嘔吐及體重減輕等症狀並在尿中出現蛋白。
危害
草酸在人體內不容易被氧化分解掉,經代謝作用後形成的產物,屬於酸性物質,可導致人體內酸鹼度失去平衡,吃得過多還會中毒。平均一個人一天大約攝入150毫克草酸,而草酸的致死劑量是1500毫克左右。
而且草酸在人體內如果遇上鈣和鋅便生成草酸鈣和草酸鋅,不易吸收而排出體外,影響鈣與鋅的吸收。
兒童生長發育需要大量的鈣和鋅。如果體內缺乏鈣和鋅,不僅可導致骨骼、牙齒髮育不良,而且還會影響智力發育。過量攝入草酸還會造成結石。
安全標誌
危險品標誌
Xn Harmful 有害物品
安全術語
S24/25Avoid contact with skin and eyes.避免與皮膚和眼睛接觸。
風險術語
R21/22Harmful in contact with skin and if swallowed. 皮膚接觸及吞食有害。

