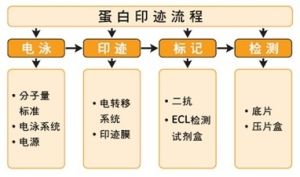
發明者
蛋白質印跡的發明者一般認為是 美國史丹福大學的喬治·斯塔克(George Stark)。在尼爾·伯奈特(Neal Burnette)於1981年所著的《 分析生物化學》(Analytical Biochemistry)中首次被稱為Western Blot。原理
 westernblot
westernblot 分類
Western Blot顯色的方法主要有以下幾種:i. 放射自顯影
ii. 底物化學發光ECL
iii. 底物螢光 ECF
iv. 底物DAB呈色
現常用的有 底物化學發光ECL和底物DAB呈色,體同水平和實驗條件的是用第一種方法,目前發表文章通常是用底物化學發光ECL。只要買現成的試劑盒就行,操作也比較簡單,原理如下(二抗用HRP標記):反應底物為過氧化物+ 魯米諾,如遇到HRP,即發光,可使膠片曝光,就可洗出條帶。
操作步驟
試劑準備
1、SDS-PAGE試劑:見電泳實驗。2、勻漿緩衝液:1.0M Tris-HCl(pH 6.8)1.Oml;10%SDS 6.0ml;β-巰基乙醇 0.2ml;ddH2O 2.8ml。
3、轉膜緩衝液:甘氨酸 2.9g;Tris 5.8g;SDS 0.37g;甲醇200ml;加ddH2O定容至1000ml。
4、0.01M PBS(pH7.4):NaCl 8.0g;KCl 0.2g;Na2HPO4 1.44g;KH2PO4 0.24g;加ddH2O至1000ml。
5、膜染色液: 考馬斯亮蘭 0.2g;甲醇80ml;乙酸2ml;ddH2O118 ml。包被液(5%脫脂奶粉,現配):脫脂奶粉1.0g 溶於20ml的0.01M PBS中。
6、顯色液:DAB 6.0mg;0.01M PBS 10.0ml;硫酸鎳胺 0.1ml;H202 1.0μl。
蛋白樣品製備
 westernblot
westernblot 1、 倒掉培養液,並將瓶倒扣在吸水紙上使吸水紙吸乾培養液(或將瓶直立放置一會兒使殘餘培養液流到瓶底然後再用移液器將其吸走)。
2、 每瓶細胞加3ml 4℃預冷的PBS(0.01M pH7.2~7.3)。平放輕輕搖動1min洗滌細胞,然後棄去洗液。重複以上操作兩次,共洗細胞三次以洗去培養液。將PBS棄淨後把培養瓶置於冰上。
3、 按1ml裂解液加10 μl PMSF(100mM),搖勻置於冰上。(PMSF要搖勻至無結晶時才可與裂解液混合。)
4、 每瓶細胞加400 μl含PMSF的裂解液,於冰上裂解30min,為使細胞充分裂解培養瓶要經常來回搖動。
5、 裂解完後,用乾淨的刮棒將細胞刮於培養瓶的一側(動作要快),然後用槍將細胞碎片和裂解液移至1.5ml離心管中。(整個操作儘量在冰上進行。)
6、 於4℃下12000rpm離心5min。(提前開離心機預冷)
7、 將離心後的上清分裝轉移倒0.5min的離心管中放於-20℃保存。
(2) 組織中總蛋白的提取:
1、 將少量組織塊置於1~2ml勻漿器中球狀部位,用乾淨的剪刀將組織塊儘量剪碎。
2、 加400 μL單去污劑裂解液裂(含PMSF)於勻漿器中,進行勻漿。然後置於冰上。
3、 幾分鐘後再碾一會兒再置於冰上,要重複碾幾次使組織儘量碾碎。
4、 裂解30 min後,即可用移液器將裂解液移至1.5ml離心管中,然後在4℃下12000rpm離心5min,取上清分裝於0.5ml離心管中並置於-20℃保存。 (3) 加藥物處理的貼壁細胞總蛋白的提取:
由於受藥物的影響,一些細胞脫落下來,所以除按(一)操作外還應收集培養液中的細胞。以下是培養液中細胞總蛋白的提取:
1、 將培養液倒至15ml離心管中,於2500rpm離心5min。
2、 棄上清,加入4ml PBS並用槍輕輕吹打洗滌,然後2500rpm離心5min。棄上清後用PBS重複洗滌一次。
3、 用槍洗幹上清後,加100 μL裂解液(含PMSF)冰上裂解30min,裂解過程中要經常彈一彈以使細胞充分裂解。
4、將裂解液與培養瓶中裂解液混在一起4℃、12000rpm離心5min,取上清分裝於0.5ml離心管中並置於-20℃保存。
蛋白含量的測定
(1) 製作標準曲線1、 從-20℃取出1mg/ml BSA,室溫融化後,備用。
2、 取18個1.5ml離心管,3個一組,分別標記為0mg,2.5mg,5.0mg,10.0mg,20.0mg,40.0mg。
3、 按下表在各管中加入各種試劑。
| | 0mg | 2.5mg | 5.0mg | 10.0mg | 20.0mg | 40.0mg |
| 1mg/ml BSA | - | 2.5ml | 5.0ml | 10.0ml | 20.0ml | 40.0ml |
| 0.15mol/L NaCl | 100ml | 97.5ml | 95.0ml | 90.0ml | 80.0ml | 60.0ml |
| G250考馬斯亮藍溶液 | 1ml | 1ml | 1ml | 1ml | 1ml | 1ml |
(2) 檢測樣品蛋白含量
1、 取足量的1.5ml離心管,每管加入4℃儲存的 考馬斯亮藍溶液1ml。室溫放置30min後即可用於測蛋白。
2、 取一管考馬斯亮藍加0.15mol/L NaCl溶液100 ml,混勻放置2分鐘可做為空白樣品,將空白倒入比色杯中在做好標準曲線的程式下按blank測空白樣品。
3、 棄空白樣品,用無水 乙醇清洗比色杯2次(每次0.5mL),再用無菌水洗一次。
4、 取一管考馬斯亮藍加95 ml0.15mol/L NaCl NaCl溶液和5ml待測蛋白樣品,混勻後靜置2min,倒入扣乾的比色杯中按sample鍵測樣品。
注意:每測一個樣品都要將比色杯用無水乙醇洗2次,無菌水洗一次。可同時混合好多個樣品再一起測,這樣對測定大量的蛋白樣品可節省很多時間。測得的結果是5 ml樣品含的蛋白量。
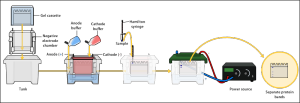
SDS-PAGE電泳
 westernblot
westernblot 一隻手扣緊玻璃板,另一隻手蘸點洗衣粉輕輕擦洗。兩面都擦洗過後用自來水沖,再用蒸餾水沖洗乾淨後立在筐里晾乾。
(2) 灌膠與上樣
1、 玻璃板對齊後放入夾中卡緊。然後垂直卡在架子上準備灌膠。(操作時要使兩玻璃對齊,以免漏膠。)
2、 按前面方法配10%分離膠,加入TEMED後立即搖勻即可灌膠。灌膠時,可用10ml槍吸取5ml膠沿玻璃放出,待膠面升到綠帶中間線高度時即可。然後膠上加一層水,液封后的膠凝的更快。(灌膠時開始可快一些,膠面快到所需高度時要放慢速度。操作時膠一定要沿玻璃板流下,這樣膠中才不會有氣泡。加水液封時要很慢,否則膠會被沖變型。)
3、 當水和膠之間有一條折射線時,說明膠已凝了。再等3min使膠充分凝固就可倒去膠上層水並用吸水紙將水吸乾。
4、 按前面方法配4%的濃縮膠,加入 TEMED後立即搖勻即可灌膠。將剩餘空間灌滿濃縮膠然後將梳子插入濃縮膠中。灌膠時也要使膠沿玻璃板流下以免膠中有氣泡產生。插梳子時要使梳子保持水平。由於膠凝固時體積會收縮減小,從而使加樣孔的上樣體積減小,所以在濃縮膠凝固的過程中要經常在兩邊補膠。待到濃縮膠凝固後,兩手分別捏住梳子的兩邊豎直向上輕輕將其拔出。
5、 用水沖洗一下濃縮膠,將其放入電泳槽中。(小玻璃板面向內,大玻璃板面向外。若只跑一塊膠,那槽另一邊要墊一塊塑膠板且有字的一面面向外。)
6、 測完蛋白含量後,計算含50 ng蛋白的溶液體積即為上樣量。取出上樣樣品至0.5ml離心管中,加入5×SDS 上樣緩衝液至終濃度為1×。(上樣總體積一般不超過15 μl,加樣孔的最大限度可加20 μl樣品。)上樣前要將樣品於沸水中煮5min使蛋白變性。
7、 加足夠的電泳液後開始準備上樣。(電泳液至少要漫過內測的小玻璃板。)用微量進樣器貼壁吸取樣品,將樣品吸出不要吸進氣泡。將加樣器針頭插至加樣孔中緩慢加入樣品。(加樣太快可使樣品衝出加樣孔,若有氣泡也可能使樣品溢出。加入下一個樣品時,進樣器需在外槽電泳緩衝液中洗滌3次,以免交叉污染。
(3) 電泳
電泳時間一般4~5 h,電壓為40V較好,也可用60V。電泳至溴酚蘭剛跑出即可終止電泳,進行轉膜。
轉膜
(1) 轉一張膜需準備6張7.0~8.3cm的濾紙和1張7.3~8.6cm的硝酸纖維素膜。切濾紙和膜時一定要戴手套,因為手上的蛋白會污染膜。將切好的硝酸纖維素膜置於水上浸2 h才可使用。(用鑷子捏住膜的一邊輕輕置於有超純水的平皿里,要使膜浮於水上,只有下層才與水接觸。這樣由於毛細管作用可使整個膜浸濕。若膜沉入水裡,膜與水之間形成一層空氣膜,這樣會阻止膜吸水。(2) 在加有轉移液的 搪瓷盤裡放入轉膜用的夾子、兩塊海綿墊、一支玻棒、濾紙和浸過的膜。
(3) 將夾子打開使黑的一面保持水平。在上面墊一張海綿墊,用玻棒來回擀幾遍以擀走裡面的氣泡。(一手擀另一手要壓住墊子使其不能隨便移動。)在墊子上墊三層濾紙(可三張紙先疊在一起在墊於墊子上),一手固定濾紙一手用玻棒擀去其中的氣泡。
(4) 要先將玻璃板撬掉才可剝膠,撬的時候動作要輕,要在兩個邊上輕輕的反覆撬。撬一會兒玻璃板便開始鬆動,直到撬去玻板。(撬時一定要小心,玻板很易裂。)除去小玻璃板後,將濃縮膠輕輕颳去(濃縮膠影響操作),要避免把分離膠刮破。小心剝下分離膠蓋於濾紙上,用手調整使其與濾紙對齊,輕輕用玻棒擀去氣泡。將膜蓋於膠上,要蓋滿整個膠(膜蓋下後不可再移動)並除氣泡。在膜上蓋3張濾紙並除去氣泡。最後蓋上另一個海綿墊,擀幾下就可合起夾子。整個操作在轉移液中進行,要不斷的擀去氣泡。膜兩邊的濾紙不能相互接觸,接觸後會發生短路。(轉移液含甲醇,操作時要戴手套,實驗室要開門以使空氣流通。)
(5) 將夾子放入轉移槽槽中,要使夾的黑面對槽的黑面,夾的白面對槽的紅面。電轉移時會產熱,在槽的一邊放一塊冰來降溫。一般用60V轉移2 h或40V轉移3 h。
(6) 轉完後將膜用1× 麗春紅染液染5min(於脫色搖床上搖)。然後用水沖洗掉沒染上的染液就可看到膜上的蛋白。將膜晾乾備用。
免疫反應
(1) 將膜用TBS從下向上浸濕後,移至含有封閉液的平皿中,室溫下脫色搖床上搖動封閉1h。(2) 將一抗用TBST稀釋至適當濃度(在1.5ml離心管中);撕下適當大小的一塊兒保鮮膜鋪於實驗檯面上,四角用水浸濕以使保鮮膜保持平整;將抗體溶液加到保鮮膜上;從封閉液中取出膜,用濾紙吸去殘留液後,將膜蛋白面朝下放於抗體液面上,掀動膜四角以趕出殘留氣泡;室溫下孵育1~2h後,用TBST在室溫下脫色搖床上洗兩次,每次10min;再用TBS洗一次,10min。
(3) 同上方法準備二抗稀釋液並與膜接觸,室溫下孵育1~2h後,用 TBST在室溫下脫色搖床上洗兩次,每次10min;再用TBS洗一次,10min,進行化學發光反應。
化學發光,顯影,定影
(1) 將A和B兩種試劑在保鮮膜上等體積混合;1min後,將膜蛋白面朝下與此混合液充分接觸;1min後,將膜移至另一保鮮膜上,去盡殘液,包好,放入X-光片夾中。(2) 在暗室中,將1×顯影液和定影液分別到入塑膠盤中;在紅燈下取出X-光片,用切紙刀剪裁適當大小(比膜的長和寬均需大1cm);打開X-光片夾,把X-光片放在膜上,一旦放上,便不能移動,關上X-光片夾,開始計時;根據信號的強弱適當調整曝光時間,一般為1min或5min,也可選擇不同時間多次壓片,以達最佳效果;曝光完成後,打開X-光片夾,取出X-光片,迅速浸入顯影液中顯影,待出現明顯條帶後,即刻終止顯影。顯影時間一般為1~2min(20~25℃),溫度過低時(低於16℃)需適當延長顯影時間;顯影結束後,馬上把X-光片浸入定影液中,定影時間一般為5~10min,以膠片透明為止;用自來水衝去殘留的定影液後,室溫下晾乾。
應注意的是:顯影和定影需移動膠片時,儘量拿膠片一角,手指甲不要劃傷膠片,否則會對結果產生影響。